

ISSN 1080-3521
EDUCATIONAL SYNOPSES IN ANESTHESIOLOGY
and
CRITICAL CARE MEDICINE - Italia -
Il giornale Italiano online di anestesia Vol 7 No 12 Dicembre 2002
Vincenzo Lanza, MDServizio di Anestesia e RianimazioneOspedale Buccheri La Ferla Fatebenefratelli Palermo, ItalyE-mail: lanza@mbox.unipa.it |
Keith J Ruskin, MDDepartment of Anesthesiology Yale University School of Medicine333 Cedar Street, New Haven, CT 06520 USAE-mail: ruskin@gasnet.med.yale.edu |
Copyright (C) 1997 Educational Synopses in Anesthesiology and Critical Care Medicine. All rights reserved. Questo rivista on-line può essere copiata e distribuita liberamente curando che venga distribuita integralmente, e che siano riportati fedelmente tutti gli autori ed il comitato editoriale. Informazioni sulla rivista sono riportate alla fine |
|
In questo numero:
ATTI CONGRESSUALI ONLINE XVII Congresso
Nazionale della Società Italiana di Terapia Intensiva S.I.T.I
dal corso "Tecniche di depurazione extra-renale continua in Terapia Intensiva"
2 Farmacocinetica della terapia di rimozione renale continua
_______________________________________________________
ATTI CONGRESSUALI ONLINE
XVII Congresso
Nazionale della Società Italiana di Terapia Intensiva S.I.T.I.
La redazione di Esia-Italia dedica
alcuni suoi numeri alla
presentazione online di una selezione degli atti del XVII Congresso Nazionale
SITI (Società Italiana di Terapia Intensiva), tenutosi nel Settembre 2003 a
Palermo.
Attraverso ESIA, i
presidenti, il comitato organizzatore e il comitato scientifico del congresso SITI hanno
deciso di offrire il materiale scientifico congressuale per la libera
consultazione online, certi di incontrare il bisogno di formazione e di
aggiornamento dei lettori: anestesisti-rianimatori, infermieri, chirurghi e altri
addetti ai lavori dell'area critica. La selezione degli articoli spazia tra le
diverse aree di interesse, valorizzando le competenze mediche e
infermieristiche delle tematiche trattate, a sottolineare che solo una crescita
culturale di tutto il gruppo di lavoro può garantire i migliori risultati di
cura sui pazienti critici.
Pertanto Esia-Italia, perseguendo le proprie finalità costitutive di strumento
elettronico di formazione scientifica e tecnica, si offre come canale di pubblicazione dei lavori
congressuali; in
ogni caso la redazione di Esia-Italia non si riterrà responsabile di errori o
di omissioni ravvisabili nei testi prodotti nè dell'eventuale impropria
utilizzazione delle tecniche descritte.
_______________________________________________________
Emodialisi ed Emofiltrazione
_______________________________________________________
Emodialisi - Emofiltrazione
N. Kaeffer, G. Oksendendler
Réanimation
Chirurgicale et Anesthésie; CHU de Rouen Cedex
L’insufficienza
renale acuta da danno tubulare è una complicazione frequente nei servizi di
terapia intensiva e di rianimazione. Essa può essere isolata o iscriversi nel
quadro di un danno multiviscerale. Un supporto per mezzo d’una epurazione
extrarenale deve essere assicurata per 2-3 settimane, nell’attesa di un
recupero soddisfacente della funzione renale. L’emodialisi intermittente è il
trattamento di riferimento in questo tipo d’affezione. Il suo uso, tuttavia, è
spesso difficile nei pazienti critici che presentano un’instabilità
emodinamica. Questi ultimi dieci anni hanno visto la nascita di nuove tecniche
di depurazione continua artero-venosa o veno-venosa fondate sul principio
dell’emofiltrazione associate o meno all’emodialisi. Per la loro facilità
d’impiego e la loro grande efficacia tendono a soppiantare l’emodialisi
intermittente in rianimazione chirurgica o polivalente.
1.1 Trasferimento per
diffusione
La
diffusione corrisponde al trasferimento di molecole per gradiente di
concentrazione attraverso una membrana semi-permeabile. Le molecole, come
l'urea, migrano dal compartimento ove la concentrazione è maggiore verso il
compartimento dove la concentrazione è meno elevata. La quantità del soluto
trasferita (Qd) dipende dal gradiente di concentrazione ma anche dalla
superficie della membrana e dal suo coefficiente di permeabilità (K).
L'equazione generale che descrive questo modo di trasferimento è la seguente:
Qd = K x S x Ci -
Co/Cuf
ove:
Ci
= concentrazione del soluto all'entrata dell'emodializzatore
Co
= concentrazione del soluto all'uscita dell'emodializzatore
Cuf
= concentrazione del soluto nel dialisato
Al
gradiente di concentrazione che regola tale modo di trasferimento s'oppongono
le resistenze riscontrate dal soluto durante il passaggio dal sangue verso il
dialisato. Queste resistenze dipendono essenzialmente dalle resistenze allo
scorrimento del sangue e del dialisato da una parte e dall'altra della membrana
e dalla resistenza della stessa membrana, determinata dallo spessore e dalle
sue proprietà fisico-chimiche. Le molecole, per le loro dimensioni si oppongono
ugualmente alla diffusione. Le piccole molecole (elettroliti, urea,
creatinina), quindi, diffondono più facilmente.
Questo
principio di diffusione è utilizzato nel corso dell'emodialisi e della dialisi
peritoneale.
1.2 Trasferimento per
convezione
La
convezione o ultrafiltrazione corrisponde al trasporto per gradiente di
pressione idrostatica. Le molecole sono trasferite dal settore in cui la
pressione è più elevata verso il settore ove la pressione è minore. Le molecole
trasferite per convezione sono accompagnate dal trasferimento del solvente
importante (fig. 1). 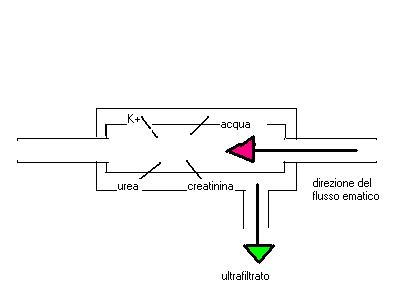
L'equazione generale che descrive questo modo di trasferimento è la
seguente:
Quf = CH2O x S x PTM
in
cui:
Quf
= quantità del soluto trasferita
CH2O
= coefficiente di permeabilità idraulica della membrana
S
= superficie della membrana
PTM
= pressione transmembrana
Il
gradiente di pressione transmembrana è un'elemento determinante del flusso
dell'ultrafiltrato. Dipende dalla pressione idrostatica dei compartimenti
ematici e di quello dell'ultrafiltrato oltre che della pressione oncotica del
sangue. E' il solo parametro che può essere modificato durante l'emofiltrazione per aumentare la
produzione dell'ultrafiltrato. Un aumento della pressione transmembranaria può
essere realizzata aumentando il flusso sanguigno con un aumento del gradiente
di pressione tra l'entrata e l'uscita del filtro e dunque un aumento della
pressione idrostatica. La riduzione della pressione oncotica plasmatica per
apporto di liquidi a monte del filtro (prediluizione) permette ugualmente di
aumentare il flusso dell'ultrafiltrato. Infine la diminuzione di pressione a
livello della camera di raccolta dell'ultrafiltrato aumenta il gradiente di
pressione idrostatica e facilita la produzione d'ultrafiltrato.
La
convezione è molto più efficace che la diffusione per l'epurazione di grosse
molecole (peptidi, mioglobina...). La proprietà delle membrane non permette
però né il passaggio di molecole di elevato peso molecolare come le proteine ne
quello degli elementi figurati del sangue.
2.1 I circuiti di emofiltrazione
o di emodialisi (fig.1)
Il
trattamento di riferimento dell'insufficienza renale acuta è rappresentato
dall'emodialisi intermittente. Da una dozzina d'anni questa tecnica tende ad
essere rimpiazzata nei servizi di rianimazione da tecniche di depurazione
extrarenale in continuo. Oltre la semplicità della messa in opera, queste nuove
tecniche assicurano un eccellente controllo del catabolismo azotato e
dell'equilibrio idroelettrolitico, con una grande stabilità emodinamica, anche
nelle situazioni precarie. Sono stati descritti diversi tipi di circuiti.
Differiscono per il modo di depurazione, convezione o diffusione, e per il
circuito sanguigno utilizzato, veno-venoso o artero-venoso.
L'emofiltrazione
artero-venosa continua (Continuous Arterio-Venous Hemofiltration: CAVH) è il
metodo d'emofiltrazione puro. Essa necessita di materiale ridotto. La pressione
arteriosa del paziente assicura la circolazione di sangue nell'emofiltro. Il
sangue proviene da un catetere inserito in un'arteria di grosso calibro che
assicura un flusso di 50-90 ml/min. Il sangue ritorna al malato attraverso un
catetere venoso. In queste condizioni, l'ultrafiltrato ottenuto è dell'ordine
di 400 ml/h e può assicurare una sostituzione del sistema renale totale. Il flusso
sanguigno del circuito in pratica, non è misurato. Solamente il flusso
dell'ultrafiltrato viene misurato. Una riduzione dell'ultrafiltrato può
corrispondere ad un abbassamento della pressione arteriosa del malato o ad una
trombosi parziale del circuito. L'ultrafiltrato raccolto in quantità importante
deve essere regolarmente compensato da un liquido di sostituzione.
La
"Slow Continuous Ultrafiltration" (SCUF) è un'emofilrazione pura
realizzata con un accesso artero-venoso. Il flusso d'ultrafiltrato è ridotto e
non necessita di compenso. Questa tecnica semplice nella realizzazione è
particolarmente interessante per combattere un'insufficienza cardiaca
congestizia resistente al trattamento usuale. Per contro, questa metodica non è
molto efficace in caso d'insufficienza renale severa.
L'emodialisi
artero-venosa continua (Continuous arterio-venous hemodialisys: CAVHD) è
derivata dalle tecniche precedenti per aggiunta di un liquido di dialisi
circolante nel compartimento di raccolta dell'ultrafiltrato. Il flusso del
dialisato è basso (0.5-4 l/h) e la circolazione del dialisato s'effettua per
controcorrente rispetto al compartimento sanguigno. Questo metodo associa
convezione e diffusione. La dialisi complementare è utile nei pazienti aventi un catabolismo intenso, e permette di
aumentare la depurazione di piccole molecole come l'urea.
Nell'uso,
le tecniche di emodialisi o di emofiltrazione artero-venose continue pongono il
problema dell'accesso vascolare arterioso di grosso calibro. Queste tecniche
hanno ugualmente l'inconveniente di non permettere il controllo del flusso
ematico e dunque del flusso dell'ultrafiltrato che ne deriva. L'introduzione
delle pompe vascolari nel circuito ha permesso di rimpiazzare i circuiti
artero-venosi con quelli veno-venosi. Così l'equivalente della CAVH è
l'emofiltrazione veno-venosa continua (Continuous vano-venous hemofiltration:
CVVH) e la CAVHD è comparabile alla "Continuous veno-venous
hemodialisys" (CVVHD).
2.2 I filtri
Esistono
due principali tipi di fibre, i filtri capillari e quelli a placche. I filtri
capillari sono composti da fibre cave all'interno delle quali circola il
sangue. L'ultrafiltrato è prodotto nei capillari e circola tra le fibre. Nei
filtri a placche, il sangue circola a contatto d'una membrana piatta semipermeabile. In rapporto agli
emofiltri tradizionali, questi nuovi filtri hanno proprietà reologiche
superiori e un volume sanguigno interno minore (40-75 ml). Le membrane possono
essere d'origine naturale (cellulosa) o sintetiche (polisulfone, pliamide, poliacrilonitrile).
Se le fibre sintetiche hanno l'inconveniente di essere più fragili, esse hanno
il vantaggio d'avere un coefficiente di permeabilità elevato e una migliore
biocompatibilità.
2.3 Gli accessi vascolari
Le
differenti tecniche d'emodialisi o d'emofiltrazione necessitano di due vie
vascolari. I cateteri utilizzati sono di grosso calibro (da 7 a 9 F). Quando il
circuito è di tipo veno-venoso, può essere utilizzato un catetere unico a due
vie. Questo deve essere inserito in una vena di grosso calibro perchè la pompa
possa aspirare il sangue secondo il
flusso fissato, senza difficoltà. Per limitare il rischio di ricircolazione tra
la via arteriosa e la via venosa, gli orifizi interni delle due vie del catetere
devono essere distanti da 8 a 10 cm. Inoltre, la via arteriosa deve avere molti
fori per evitare che la vena si collabisca durante il funzionamento della
pompa. I grossi tronchi venosi, femorale, succlavia e giugulare interno
permettono il posizionamento di tali cateteri.
Quando
la tecnica scelta è di tipo artero-venosa, l'arteria scelta deve essere di buon
calibro per assicurare un flusso sanguigno nel circuito. L'arteria abitualmente
utilizzata è l'arteria femorale. E' un'accesso facile ma esiste un rischio di
trombosi non trascurabile, imponendo la prudenza in un paziente ateromatoso.
Gli accessi arteriosi espongono ugualmente a un rischio emorragico in
particolar modo alla rimozione del catetere. La rimozione del catetere impone
dunque una compressione prolungata e questo in assenza di anticoagulazione.
2.4 Anticoagulazione del circuito
La
circolazione extra-corporea, mettendo in contatto il sangue e dei materiali
esogeni determina l'attivazione della coagulazione, favorendo la trombosi
dell'emofiltro e del circuito. Questa trombosi riduce l'efficacia
dell'emofiltro e può condurre ad una perdita sanguigna in caso di trombosi
brutale dell'insieme del circuito impedendo la restituzione del sangue. Un
trattamento anticoagulante è dunque necessario per garantire l'efficacia
dell'epurazione e prolungare la durata d'utilizzazione del filtro. Questo
impone una stretta sorveglianza dell'anticoagulazione tenuto conto dell'elevato
rischio emorragico nel malato a rischio, politraumatizzato o operato di
recente. L'eparina è l'agente più comunemente utilizzato. Dopo somministrazione
d'una dose di carico, l'eparina viene somministrata in continuo tramite una
siringa elettrica a monte del circuito d'emofiltrazione. L'eliminazione
dell'eparina per emofiltrazione è modesta e la maggior parte della dose somministrata
si ritrova a livello della linea venosa.
Per
migliorare l'efficacia antitrombotica dell'eparina, è importante realizzare
l'impregnazione iniziale del circuito con una grande quantità d'eparina per
ottenere una saturazione della membrana dell'emofiltro prima dell'inizio
dell'emofiltrazione. Il principale inconveniente dell'eparina è la comparsa di
complicazioni emorragiche valutate al 30%. Esistono anche altre tecniche
d'anticoagulazione. Le eparine di basso peso molecolare, l'eparinizzazione regionale
con antagonismo ad opera della protamina, la prostaciclina, il citrato di
sodio, il gabexata mesilato (inibitore degli enzimi della coagulazione sono
alternative utilizzabili. Può anche essere attuabile l'assenza di
anticoagulazione, con pulizia regolare del circuito con soluzione fisiologica.
I protocolli d'uso sono riassunti nella tavola seguente. Gli schemi
d'anticoagulazione sono identici sia che si tratti d'emofiltrazione che di
dialisi.
La
coagulazione a livello del circuito è dipendente anche dalla tecnica
d'emofiltrazione. Così, una pressione transmembranaria elevata con una
produzione importante d'ultrafiltrato determina un'emoconcentrazione nel filtro
e favorisce la trombosi. Bassi flussi
sanguigni, senza eccessi di pressione transmembranaria, favoriscono alla stesso
modo trombosi localizzate che si
possono estendere rapidamente a tutto il filtro.
La
prediluizione, con somministrazione del liquido di sostituzione a monte del
filtro, riduce il bisogno di anticoagulazione. La diluizione così indotta
migliora le condizioni reologiche nel filtro e riduce la concentrazione dei
fattori di coagulazione a livello del filtro.
Il
controllo dell'anticoagulazione è clinico e biologico. Il rischio trombotico
viene valutato con l'osservazione del circuito alla ricerca della
sedimentazione delle cellule sanguigne. Una riduzione dell'ultrafiltrato è un
buon criterio di diminuizione di permeabilità della membrana. Il rischio
emorragico viene sorvegliato con la realizzazione pluriquotidiana del tempo di
cefalina attivato e dalla misura giornaliera del tasso piastrinico e
dell'attività anti-Xa se vengono utilizzate eparine a basso peso molecolare.
2.5 Sostituzione dei liquidi ultrafiltrati
Esistono
numerose soluzioni di restituzione la cui composizione ionica è simile a quella
del plasma. Queste soluzioni sono leggermente arricchite in sodio, mentre le
concentrazioni di potassio, calcio, fosforo e magnesio sono lievemente
inferiori a quelle del plasma. L'elettroneutralità della soluzione è assicurata
dall'aggiunta di lattato, bicarbonato o di acetato.
La
restituzione del liquido può avvenire a qualunque sito del circuito. Può essere
interessante realizzare una prediluizione somministrando il liquido di
restituzione a monte del filtro. La prediluizione, oltre al vantaggio in
termini di anticoagulazione, tende ad aumentare il flusso d'ultrafiltrazione
riducendo la pressione oncotica legata principalmente alle proteine
plasmatiche, principale fattore che si oppone all'ultrafiltrazione. Questa
tecnica è interessante soprattutto in emofiltrazione pura. Una dialisi
associata, in effetti, sarebbe meno efficace per la diluizione del plasma. La
restituzione a valle del circuito o post-diluizione riduce l'emoconcentrazione
e partecipa alla prevenzione della trombosi del circuito venoso.
L'emofiltrazione
o l'emodiafiltrazione determina la mobilizzazione di volumi idrici importanti
nelle 24 ore. La restituzione effettuata in continuo deve essere aggiustata
ogni ora. Nelle prime ore d'emofiltrazione, una compensazione anticipata è
utile tenuto conto dell'entità dei volumi scambiati.
I
volumi di restituzione sono determinati in funzione dello stato d'idratazione
del paziente e di altri apporti liquidi giornalieri: nutrizione, farmaci o
riempimento vascolare.
2.6 Liquido di dialisi
Quando
si associa un'emodialisi ad un'emofiltrazione, si somministra un liquido di
dialisi controcorrente nel compartimento di raccolta dell'ultrafiltrato. La
composizione può essere determinata in funzione degli obiettivi terapeutici. In
pratica, si tratta degli stessi soluti usati per la restituzione. E'
indispensabile che il liquido di dialisi sia sterile poichè circola a contatto
della membrana d'emofiltrazione semi-permeabile.
3.
Risultati
3.1 Clearance
Le
clearance delle piccole molecole sono maggiori in dialisi intermittente
convenzionale che in emofiltrazione continua. La drastica riduzione della
creatinina osservata in emodialisi intermittente si verifica soprattutto a
spese del settore vascolare. Un aumento rapido della creatininemia si osserva
nelle ore che seguono per riequilibrio delle concentrazioni con il settore
intracellulare. L'emo(dia)filtrazione continua, malgrado delle clearance
inferiori, permette scambi continui con i differenti compartimenti
dell'organismo. In totale, se le tecniche d'epurazione intermittente e continua
sono confrontate per la durata di una settimana, l'emo(dia)filtrazione si
rivela la più efficace per la rimozione delle piccole molecole. Tuttavia,
quando la messa in opera dell'emofiltrazione è tardiva in rapporto
all'evoluzione dell'insufficienza renale (uremia = 40-50 mmol/l),
l'utilizzazione dell'emofiltrazione continua da sola è insufficiente imponendo
il ricorso all'emodiafiltrazione.
3.2 Scambi acido-base e idroelettrolitici
Nei
pazienti in insufficienza renale acuta si osserva frequentemente un
sovraccarico idrosodico. Questa è tanto più evidente nei malati di
rianimazione, oligo-anurici, che hanno spesso apporti idrici inadatti e troppo
importanti ma inevitabili per via dei trattamenti medicamentosi. Durante una
dialisi convenzionale si può realizzare una sottrazione d'ultrafiltrato. Questa
si rivela difficile in pratica per la scarsa tolleranza emodinamica di questi
malati. Grandi volumi di liquidi vengono sottratti in un breve periodo nel settore vascolare mentre i trasferimenti
tra il settore interstiziale e quello vascolare s'effettuano meno rapidamente,
creando un'ipovolemia relativa. In emofiltrazione continua, l'ultrafiltrato
viene eliminato più lentamente permettendo l'equilibrio idrico tra i diversi
settori contemporaneamente.
I
disordini elettrolitici sono controllati efficacemente dalla sola
emofiltrazione. L'iperkaliemia è tuttavia corretta meno velocemente in
emofiltrazione che in emodialisi, giustificando il ricorso
all'emodiafiltrazione.
L'ultrafiltrazione
s'accompagna a perdite obbligatorie di calcio, magnesio e fosforo che devono
essere compensate. L'emodiafiltrazione continua corregge efficacemente
l'acidosi metabolica. Benché l'ultrafiltrato conduce alla perdita di ioni H+
e HCO3-, l'apporto di ioni bicarbonato è assicurato dal
tampone utilizzato. Questa tecnica ha il vantaggio di correggere
progressivamente l'acidosi metabolica evitando un apporto brutale di
bicarbonati di cui è stato descritto l'effetto negativo. E' preferibile che il
tampone del liquido di sostituzione sia il bicarbonato, mentre l'acetato o il
lattato rischiano di provocare un'iperlattatemia tanto più grave in quanto
esiste uno stato di shock o un'insufficienza epatocellulare.
3.3 Farmacocinetica dei
medicamenti
Numerosi
farmaci utilizzati in rianimazione hanno un'eliminazione renale. In caso
d'insufficienza renale acuta e di emodialisi intermittente, la loro posologia è
adattata in funzione dell'impatto dell'emodialisi sulla loro eliminazione
secondo regole ben definite. Questi adattamenti di posologia sono difficilmente
applicabili all'emodiafiltrazione continua,
essendo le clearance dei farmaci diverse a seconda delle tecniche depurative
utilizzate. Gli adattamenti del trattamento s'effettuano in funzione
dell'effetto ricercato stimato clinicamente, o, se possibile, con il dosaggio
sierico. Sembra opportuno utilizzare filtri per i quali la filtrazione dei
farmaci è meglio conosciuta.
3.4 Tolleranza emodinamica
E'
attualmente ammesso che la tolleranza emodinamica dell'emodiafiltrazione
continua è superiore a quella dell'emodialisi intermittente. Gli effetti
emodinamici dell'emodialisi intermittente sono il risultato di diversi
meccanismi. Esiste una riduzione della volemia efficace legata
all'ultrafiltrazione rapida, un'attivazione del complemento sulle membrane, con
liberazione d'interleuchina-1 responsabile d'una ipertensione arteriosa
polmonare e d'una ipotensione sistemica. Una correzione troppo rapida
dell'acidosi metabolica può essere responsabile d'una venodilatazione per
l'ipercapnia indotta. La migliore tolleranza dell'emofiltrazione continua riposa
sulle meno brusche variazioni osmotiche e idriche con una maggiore efficacia
nell'epurazione delle molecole vasoattive di peso molecolare elevate.
3.5 Assistenza nutrizionale
L'insufficienza
renale acuta quando è associata ad una defaillance multiviscerale s'accompagna
ad un ipercatabolismo intenso. La tendenza attuale consiste nel compensare le
perdite caloriche-azotate, secondo le regole applicate ai malati in
rianimazione non dialisati, controllando l'equilibrio idroelettrolitico e i
cataboliti azotati con l'emodiafiltrazione.
Il
ricorso alla nutrizione parenterale deve tenere conto di qualche particolarità
propria dell'emofiltrazione. L'eliminazione di glucosio è costante e
proporzionale al flusso dell'ultrafiltrato. L'impiego di soluti di dialisi arricchiti
in glucosio s'accompagna ad un'estrazione di glucosio dell'ordine del 60% che
si dovrà conteggiare negli apporti nutritivi. I lipidi non sono ultrafiltrati.
Le emulsioni lipidiche sono accusate di ridurre l'ultrafiltrazione e di
favorire la trombosi del filtro. Gli aminoacidi sono parzialmente eliminati
dall'emo(dia)filtrazione. Le perdite rappresentano circa il 10% degli apporti
ma variano da un aminoacido ad un altro.
4.1 Controllo termico
Come
tutte le tecniche di circolazione extra-corporea, l'epurazione extrarenale
qualunque sia la tecnica utilizzata è responsabile di un'importante dispersione
termica con abbassamento importante della temperatura del paziente. Il
controllo dell'ipotermia può essere difficile e necessita l'uso di diverse
tecniche di riscaldamento (materassi riscaldanti, riscaldamento del dialisato e
dei liquidi di sostituzione, isolamento del circuito) al fine di mantenere la
temperatura superiore a 35.5°C.
4.2 Rischio infettivi
Esso
è importante e legato, nelle tecniche di circolazione extra-corporee continue
all'incannulamento vascolare prolungato e alle numerose manipolazioni
necessarie dei liquidi di dialisi e di sostituzione. Tutti gli interventi sul
circuito devono dunque essere realizzati con una grande attenzione all'asepsi.
Il rischio infettivo giustifica la realizzazione quotidiana d'una emocoltura
sulla linea venosa del circuito.
L'emofiltrazione
continua viene attualmente studiata nel trattamento dello shock settico. Si è osservato
un effetto emodinamico positivo, ma il beneficio in termini d mortalità non è
stata provata. La sua efficacia potrebbe essere legata alla filtrazione delle
citochine circolanti o all'adsorbimento del LPS sulle membrane filtranti.
Conclusioni
Il
trattamento dell'insufficienza renale acuta in rianimazione con
l'emofiltrazione o l'emodiafiltrazione continua ben s'adatta alle esigenze
terapeutiche del malato di rianimazione, così come dimostra l'affermazione di
queste tecniche a danno dell'emodialisi intermittente convenzionale.
L'emofiltrazione permette un controllo efficace delle turbe idroelettrolitiche
e acido-base oltre che una rimozione efficace delle scorie azotate. La sua
buona tolleranza emodinamica permette di proporre questa metodica di depurazione
a pazienti fragili con defaillance multiviscerale. Essa presenta tuttavia degli
inconvenienti non trascurabili rappresentati dal rischio infettivo ed
emorragico legato all'anticoagulazione. La messa in opera di questa tecnica
implica un costo superiore all'emodialisi convenzionale in ragione del carico
d'assistenza supplementare. Il miglioramento della prognosi renale e vitale dei
pazienti che sembra profilarsi attualmente giustifica il suo impiego. Se
l'insufficienza renale acuta è l'indicazione preferenziale di questa tecnica,
nuove indicazioni tra le quali lo shock
settico e la defaillance multiviscerale sono in corso di valutazione.
1. Bellomo R. Recent
advances in acute renal replacement therapy. In: Vincent JL, ed. Yearbook of
intensive care and emergency medecine. Berlin: Springer Verlag, 1993:311 -19.
2. Grootendorst AF, van
Bommel EFH. Continuous hemofiltration as adjunctive therapy in septic shock and
MOF: fact or fiction?. In: Vincent JL, ed. Yearbook of intensive care and emergency medecine.
Berlin: Springer Verlag, 1993:320-26.
3. Jumbo P, Ichai C,
Grimaud D. L’hemofiltration continue: une methode adaptee au treatment de
l’insuffisance renale aigue en reanimation. In:
Dartayet B ed. Communications
scientifiques MAPAR 1993. Paris: MAPAR Editions, 1993: 677-710.
4. Journeys D.
Hemofiltration continue. Paris: Elsevier,1993:227.
5. Lazarus JM, Hakim RM. Medical aspects of hemodialysis. In: Brenner BM, Rector FC, eds. The kidney, volume ll. Philadelphia: WB Saunders Company, 1991 :2223-98.