

ISSN 1080-3521
EDUCATIONAL SYNOPSES IN ANESTHESIOLOGY
and
CRITICAL CARE MEDICINE - Italia -
Il giornale Italiano online di anestesia Vol 5 No 11 Novembre 2000
Vincenzo Lanza, MDServizio di Anestesia e RianimazioneOspedale Buccheri La Ferla Fatebenefratelli Palermo, ItalyE-mail: lanza@mbox.unipa.it |
Keith J Ruskin, MDDepartment of Anesthesiology Yale University School of Medicine333 Cedar Street, New Haven, CT 06520 USAE-mail: ruskin@gasnet.med.yale.edu |
Copyright (C) 1997 Educational Synopses in Anesthesiology and Critical Care Medicine. All rights reserved. Questo rivista on-line può essere copiata e distribuita liberamente curando che venga distribuita integralmente, e che siano riportati fedelmente tutti gli autori ed il comitato editoriale. Informazioni sulla rivista sono riportate alla fine |
|
In questo numero:
1 UPDATE NELLE INTOSSICAZIONI: LA RELAZIONE FRA TOSSICOCINETICA E TOSSICODINAMICA ED IL CONCETTO DI DINETICA
2 Trattamento del dolore da arteriopatia obliterante degli arti inferiori: esperienza con blocco peridurale continuo e con stimolazione midollare
_______________________________________________________
UPDATE NELLE INTOSSICAZIONI: LA RELAZIONE FRA TOSSICOCINETICA E TOSSICODINAMICA ED IL CONCETTO DI DINETICA
_______________________________________________________
Roberto Zoppellari , Servizio di Anestesia e
Rianimazione, Arcispedale S. Anna, Azienda Universitaria Ospedaliera di Ferrara
E-mail: capoguida@agesci.org
Le
intossicazioni sono dovute all’interazione di una o più sostanze tossiche con
l’organismo.
L’ interazione richiede generalmente l’assorbimento, la
distribuzione ed il raggiungimento di una concentrazione critica del tossico a
livello di alcuni siti cellulari. Tale concentrazione determina una
modificazione cellulare. A sua
volta l’entità della modificazione cellulare si manifesta nell’espressione
clinica dell’intossicazione.
Tali concetti sono ben esplicitati dalla definizione di tossicocinetica e di tossicodinamica.
La tossicocinetica studia, nel paziente intossicato, i processi di assorbimento, di distribuzione, di metabolizzazione e di eliminazione delle sostanze tossiche. A differenza della farmacocinetica, che tratta della cinetica dei farmaci, la tossicocinetica è la cinetica dei tossici o dei farmaci assunti in overdose. Infatti l’eccesso di dose può modificare la normale cinetica del farmaco tramite diverse modalità:
la precipitazione della sostanza nel tratto gastrointestinale e la conseguente modificazione della quota assorbita;
la saturazione degli enzimi epatici con ripercussione sull’effetto di primo passaggio e sulla metabolizzazione che può risultare protratta nel tempo;
la saturazione delle proteine plasmatiche vettrici del farmaco con aumento della frazione libera di farmaco, che è la frazione efficace.
Anche se la cinetica di un farmaco a dosi terapeutiche può differenziarsi da quella successiva a dosi tossiche, le implicazioni cliniche derivanti dalla conoscenza della cinetica di base possono essere utili nell’approccio terapeutico delle intossicazioni. Ad esempio le tecniche di eliminazione extracorporea risultano inefficaci nelle intossicazioni da benzodiazepine, farmaci che presentano normalmente una elevata clearance totale.
La tossicocinetica può essere definita come la relazione quantitativa fra la dose e l’andamento della sostanza tossica nel sangue e/o nei tessuti. La cinetica studia infatti il destino di uno xenobiotico indipendentemente dai suoi effetti.
Invece la tossicodinamica studia la relazione quantitativa fra la dose del tossico e l’entità dell’effetto biologico, indipendentemente dal tempo. Si distingue la farmacodinamica dalla tossicodinamica a seconda dell’effetto biologico: terapeuticamente efficace nel primo caso, comportante tossicità nel secondo.
Questo elaborato presenta alcuni nuovi concetti di tossicologia clinica, presentati al XX International Congress of the European Association of Poisons Centres and Clinical Toxicologists (Amsterdam, 2-5.05.2000), quali la relazione fra tossicocinetica e tossicodinamica ed il concetto di dinetica.
La relazione fra tossicocinetica e tossicodinamica descrive il rapporto fra l’andamento temporale della concentrazione della sostanza ed il suo effetto biologico 1. Questa relazione dipende dai seguenti fattori 1:
1. il meccanismo di azione del tossico;
2. il tipo di relazione fra la dose (o la concentrazione) e l’effetto tossico;
3. i fattori in grado di modificare la relazione fra la dose ed i sintomi.
1. Il meccanismo di azione del tossico
Le sostanze tossiche possono essere classificate in tre categorie a seconda del meccanismo di azione: funzionali, lesionali e dotate di entrambi i meccanismi di azione.
I tossici funzionali compromettono la funzione di uno o più organi. La tossicità è direttamente legata alla concentrazione a livello dell’organo bersaglio o del recettore. Solo quando la concentrazione plasmatica raggiunge un valore critico insorgono i sintomi. L’intossicazione che ne consegue è tanto più grave quanto maggiore è la concentrazione del tossico. Inoltre l’intossicazione presenta una durata in funzione dell’emivita plasmatica e della riduzione del livello di tossico sull’organo bersaglio. I pazienti esposti a tossici funzionali possono guarire completamente se non insorgono complicanze.
Esempi di tossici funzionali sono: alcool etilico, psicofarmaci, litio, farmaci interagenti con la funzione cardiaca, teofillina. Nel caso dell’etanolo e dei barbiturici, la gravità dell’intossicazione, intesa come profondità del coma, è direttamente dipendente dalla concentrazione plasmatica. E’ da ricordare peraltro che, se lo psicofarmaco (ad esempio benzodiazepina o triciclico) viene metabolizzato in metaboliti attivi, che routinariamente non sono analizzati, la relazione fra la concentrazione plasmatica del farmaco ed i sintomi viene meno.
I tossici lesionali sono responsabili di danno cellulare organico. Dopo che il danno cellulare si è realizzato, la sintomatologia può non regredire anche se tutto il tossico viene eliminato dall’organismo. La tossicità è dipendente dalla concentrazione plasmatica massimale raggiunta sull’organo bersaglio dopo un determinato tempo dall’esposizione.
Sono tossici lesionali il paraquat, il paracetamolo, le amatossine ed i metalli pesanti. La concentrazione plasmatica rappresenta un ottimo criterio prognostico: la determinazione analitica di determinati valori ematici di paraquat o di paracetamolo nella fase precoce dell’intossicazione è rispettivamente connessa ad outcome fatale 2 o a sviluppo di compromissione epatica 3.
Infine alcune sostanze tossiche agiscono con l’organismo con modalità sia funzionali che lesionali. I tossici che rientrano in questa categoria sono tipicamente responsabili di alterazione funzionale, cui si somma il danno cellulare realizzatosi in seguito allo sviluppo di ipossia protratta (come nell’avvelenamento da monossido di carbonio o da cianuro), o di accumulo di metaboliti citotossici (intossicazione da glicole etilenico o metanolo). Per interpretare la tossicità è necessario considerare sia i dati cinetici del composto o dei suoi metaboliti, sia la durata dell’esposizione o il tempo trascorso dalla stessa 4.
Nel caso del metanolo, la tossicità dello stesso non metabolizzato è simile a quella dell’alcool etilico. La concentrazione di metanolo determinata precocemente consente di stimare il rischio di tossicità. Peraltro la tossicità effettiva è funzione della concentrazione dei metaboliti citotossici (formaldeide ed acido formico).
2. Il tipo di relazione fra la dose (o la concentrazione) e l’effetto tossico
Di seguito sono mostrate 3 figure che illustrano alcune possibili relazioni fra la dose e l’effetto tossico.
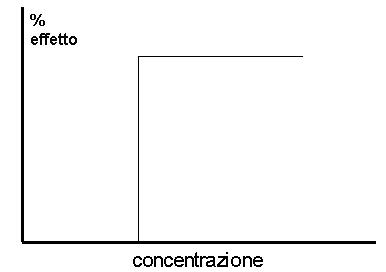
Il primo grafico presenta come l’effetto tossico possa insorgere, con entità tutto o nulla, solo quando viene superato un valore soglia di dose tossica (figura 1). L’esempio tipico di questa relazione è rappresentato dall’effetto tossico indotto dai cancerogeni.
Figura
1: effetto tossico insorgente al raggiungimento di concentrazione soglia di
sostanza tossica
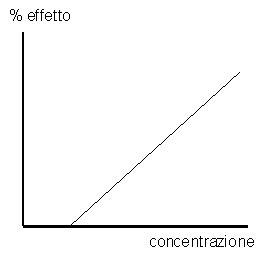
Nel secondo grafico il rapporto fra dose – o concentrazione plasmatica - ed effetto segue una correlazione lineare (figura 2).
Figura
2: effetto tossico proporzionale alla concentrazione ematica
Infine il terzo grafico mostra un effetto dipendente dalla dose secondo una curva sigmoidale (figura 3).
Figura
3: correlazione sigmoidale fra concentrazione ematica ed effetto (vedi testo)
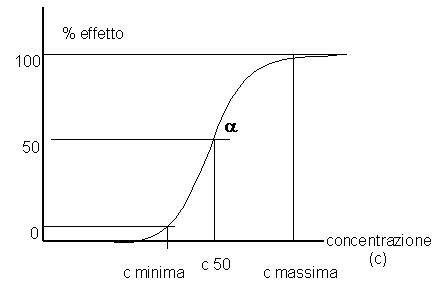
Questa correlazione sigmoidale, che descrive il rapporto fra la concentrazione ematica e la percentuale dell’effetto, presenta:
un valore di concentrazione al di sotto del quale non si manifesta l’effetto tossico;
un livello ematico per il quale si ha l’effetto massimale ed oltre il quale ulteriori aumenti della concentrazione non comportano aumenti della tossicità;
una pendenza della tossicità variabile, espressa dall’angolo a;
Conoscendo la pendenza della tossicità e la concentrazione corrispondente all’effetto massimale, è possibile calcolare la concentrazione ematica relativa a metà dell’effetto massimale.
Secondo questo modello la relazione fra cinetica e dinamica può essere descritta da una correlazione sigmoidale, che identifica un livello di massima intensità dell’effetto, spiegabile dalla saturazione di tutti i recettori da parte della sostanza tossica.
3. I fattori in grado di modificare la relazione fra la dose ed i sintomi
Le variazioni della relazione fra dose – o concentrazione - e sintomi, cioè fra tossicocinetica e tossicodinamica, sono imputabili a diversi fattori, quali 1 :
- tipo di intossicazione;
- età del soggetto intossicato;
- presenza di malattie concomitanti;
- contemporanea ingestione di altri composti;
- entità della dose ingerita;
- sviluppo di tolleranza;
- formazione di metaboliti attivi;
- ritardo fra ingestione e riscontro analitico.
- Tipo di intossicazione
Un fattore di variazione della relazione è rappresentato dal tipo di intossicazione: a parità di concentrazione plasmatica di tossico, un’intossicazione acuta può presentare un livello di gravità minore rispetto ad un’assunzione cronica, come accennato negli esempi di seguito descritti.
In uno studio comprendente oltre 140 casi di intossicazione da teofillina, i sintomi tossici si manifestarono nella forma cronica a concentrazioni plasmatiche minori rispetto all’overdose acuta 5.
Nell’intossicazione cronica da litio, la tossicità sul sistema nervoso centrale può manifestarsi per livelli plasmatici appena superiori a quelli terapeutici; all’opposto in alcuni casi di intossicazione acuta non sono stati riportati sintomi tossici pur in presenza di elevate concentrazioni plasmatiche 6.
- Età del soggetto intossicato
A parità di teofillinemia, i sintomi e la prognosi dell’intossicazione cronica da teofillina sono più gravi nell’anziano, in quanto la clearance endogena del farmaco si riduce con l’età.
- Presenza di malattie concomitanti
La tossicocinetica della teofillina può essere modificata da fattori che ne riducono il metabolismo epatico, quali un’insufficienza cardiaca congestizia, un’insufficienza epatica od uno stato di shock che comporti ipoperfusione del fegato.
Altri esempi sono rappresentati dal maggiore rischio di tossicità indotto da sostanze ad effetto epilettogeno nei soggetti epilettici o da sostanze agenti sul cuore nei pazienti cardiopatici.
- Ingestione contemporanea di altri composti
Anche l’ingestione contemporanea di altri farmaci può influire sulla tossicità. E’ il caso dell’ingestione di sostanze anticolinergiche, che può modificare la cinetica prolungando il tempo di assorbimento.
- Entità della dose ingerita
La dose ingerita può modificare la biodisponibilità del farmaco assunto in overdose, il legame con le proteine ed il metabolismo epatico.
La modificazione del legame proteico può rappresentare un elemento confondente la relazione fra i livelli ematici del tossico e lo stato del paziente 7.
Quando la concentrazione ematica di salicilato e teofillina è compresa nell’intervallo terapeutico, la cinetica di metabolizzazione di questi farmaci è di primo ordine, cioè dose-dipendente e perciò caratterizzata da una riduzione della concentrazione plasmatica nel tempo proporzionale alla concentrazione stessa. Tuttavia, nell’intossicazione massiva da teofillina o da salicilato, la cinetica di metabolizzazione può variare in cinetica di ordine zero: la quantità di farmaco metabolizzato rimane costante nell’unità di tempo. Questo fenomeno, riscontrato anche per altri farmaci, è imputabile alla saturazione progressiva della capacità di metabolizzazione epatica 7.
- Sviluppo di tolleranza
L’alcool ed i barbiturici possono indurre tolleranza cinetica da induzione enzimatica, mentre gli oppioidi sviluppano tolleranza dinamica.
- Ritardo fra ingestione e riscontro analitico
Un altro elemento responsabile di possibile distorsione della relazione fra cinetica e dinamica è rappresentato dall’intervallo di tempo fra l’esposizione alla sostanza tossica ed il primo campionamento effettuato. Ne consegue una possibile discrepanza fra la concentrazione di picco misurata e la concentrazione effettiva di picco dell’intossicazione Ad esempio, la potenziale gravità dell’intossicazione da paracetamolo può essere valutata correttamente solo con la determinazione della concentrazione effettiva di picco. Inoltre, nell’intossicazione acuta da litio, per correlare correttamente la sintomatologia ai livelli plasmatici riscontrati, è necessario attendere il completamento della fase distributiva 6.
- Formazione di metaboliti attivi
Infine la relazione fra tossicocinetica e tossicodinamica è influenzata dalla presenza di metaboliti attivi del farmaco assunto in overdose, come nel caso delle benzodiazepine e dei triciclici.
La relazione fra tossicocinetica e tossicodinamica permette di descrivere e di quantificare, nello stesso individuo, il rapporto fra l’andamento temporale della concentrazione della sostanza ed il suo effetto biologico 8. Questa relazione ha alcune applicazioni nella valutazione della prognosi e nella verifica dell’efficacia dei trattamenti. Nell’intossicazione da paracetamolo e paraquat è comprovato il valore prognostico della concentrazione ematica, che è un dato tossicocinetico, rispetto alla probabilità di morte, che rappresenta un parametro tossicodinamico 9. Inoltre la strategia terapeutica deve utilizzare i parametri cinetici e dinamici per la valutazione dell’efficacia delle metodiche di decontaminazione, delle tecniche di eliminazione e dei trattamenti antidotici: modificazione dell’emivita plasmatica, determinazione delle quantità eliminate con i normali emuntori o tramite trattamenti specifici, effettiva prevenzione, riduzione o reversione degli effetti tossici 1.
La relazione fra tossicocinetica e tossicodinamica è stata recentemente espressa come dinetica 10. La dinetica studia la cinetica degli eventi dinamici. Essa mette in relazione il destino del tossico nell’organismo con i suoi effetti biologici. Il confronto simultaneo dell’andamento temporale della concentrazione del tossico con lo svolgersi dell’effetto biologico permette di mettere in relazione l’esordio, l’entità, la durata ed il declino degli effetti dinamici con l’incremento ed il successivo decadimento del livello ematico della sostanza 9.
Idealmente la componente ematica in cui il tossico viene determinato dovrebbe rifletterne la concentrazione a livello della biofase, compartimento virtuale contenente i recettori specifici sui quali agisce il composto. La stretta associazione fra concentrazione nel sangue e nella biofase implica che ogni variazione del livello ematico dovrebbe tradursi in un’immediata variazione della grandezza dell’effetto.
La dinetica studia quale effetto o quali effetti sono rilevanti nell’intossicazione, quando essi si manifestano (onset, grandezza, durata) ed infine quale composto causa ciascun effetto.
Il concetto di dinetica comporta due importanti implicazioni:
La rivisitazione della stadiazione dell’intossicazione, attuata integrando la cascata di eventi patofisiologici con i segni e sintomi osservati in ciascuna fase; questa descrizione di un fenomeno tossico è utile soprattutto se il meccanismo di tossicità della sostanza avviene per stadi – come nell’avvelenamento da paraquat o da glicole etilenico – piuttosto che attraverso una singola modalità, come nell’overdose da benzodiazepina.
La definizione precisa dell’efficacia di una terapia. Infatti la valutazione di un trattamento, come l’eliminazione extracorporea o la somministrazione di un antidoto, va rapportata alla fase dinetica dell’intossicazione durante la quale esso viene proposto.
Ad esempio il 4metilpirazolo, o fomepizolo, nuovo antidoto disponibile per l’intossicazione da glicole etilenico e da metanolo, è efficace se la concentrazione plasmatica dei metaboliti dei due prodotti risulta essere bassa. Il fomepizolo risulta invece privo di efficacia se glicole etilenico e metanolo presentano un basso livello ematico, mentre la concentrazione dei loro metaboliti è elevata. Questa diversità di effetto è dovuta al fatto che l’antidoto, competendo con l’alcool deidrogenasi, inibisce la trasformazione dell’etilenglicole e del metanolo in metaboliti tossici 11.
In conclusione la dinetica rappresenta la cronologia degli effetti tossici e la dipendenza di un effetto da un altro, nel tentativo di integrare i meccanismi di tossicità e di spiegare la patofisiologia dell’intossicazione e la sintomatologia presente in quel momento 10.
Bibliografia:
Jaeger A, Harlay ML, Wolter P, Gayol S. Kinetic-dynamic relationship - Principles. J Toxicol Clin Toxicol 2000; 2: 207-8.
Proudfoot AT, Steward MS, Levitt T, Widdop B. Paraquat poisoning: significance of plasma-paraquat concentrations. Lancet 1979; ii: 330-2.
Howland MA. Acetaminophen poisoning and the use of N-acetylcysteine. In (proceedings) Recent issues in clinical toxicology - Antidotes in depth. Pavia 10-12.7.2000, p. 66-70.
Jaeger A. Are kinetic investigations feasible in human poisoning? Toxicol Lett 1998; 102-3: 637-42.
Shannon M & Lovejoy FH. Life threatening events after theophyine intoxication: a prospective analysis of 144 cases. Ann Emerg Med 1989; 18: 446.
Jaeger A, Sauder P, Kopferschmitt J, Tritsch L, Flesch F. When should dialysis be performed in lithium poisoning? A kinetic study in 14 cases of lithium poisoning. Clin Toxicol 1993; 31 (3): 429-47.
Manzo L, Locatelli C, Tonini M. La farmacocinetica nelle intossicazioni acute. ESIA-Italia The Online Journal of Anesthesiology (indirizzo: http://anestit.unipa.it/esiait/esiafram.htm) 1998; 3, n. 10 (ottobre).
Venitz J. Pharmacokinetic-pharmacodynamic modelling of reversible drug effects. In Derendorf H & Hochhaus G (Eds). Handbook of pharmacokinetic/pharmacodynamic correlation. CRC Press, London, 1995, p. 1-34.
Baud F. Pharmacokinetic-pharmacodynamic relationships. How are they useful in human toxicology? Toxicol Lett 1998; 102-3: 643-8.
Baud FJ, Borron SW, Bismuth C. Dynetics - A new concept in toxicology. J Toxicol Clin Toxicol 2000; 2: 208.
Borron SW. New frontiers in clinical toxicology. In Speciale tossicologia “Presente e futuro in tossicologia clinica”. ESIA-Italia The Online Journal of Anesthesiology (indirizzo: http://anestit.unipa.it/esiait/esiafram.htm) 1997; 2, n. 11 (novembre).