

ISSN 1080-3521
EDUCATIONAL SYNOPSES IN ANESTHESIOLOGY
and
CRITICAL CARE MEDICINE - Italia -
Il giornale Italiano online di anestesia Vol 9 No 08 Agosto 2004
Vincenzo Lanza, MDServizio di Anestesia e RianimazioneOspedale Buccheri La Ferla Fatebenefratelli Palermo, ItalyE-mail: lanza@mbox.unipa.it |
Keith J Ruskin, MDDepartment of Anesthesiology Yale University School of Medicine333 Cedar Street, New Haven, CT 06520 USAE-mail: ruskin@gasnet.med.yale.edu |
Copyright (C) 1997 Educational Synopses in Anesthesiology and Critical Care Medicine. All rights reserved. Questo rivista on-line può essere copiata e distribuita liberamente curando che venga distribuita integralmente, e che siano riportati fedelmente tutti gli autori ed il comitato editoriale. Informazioni sulla rivista sono riportate alla fine |
|
La redazione di Esia-Italia dedica
alcuni suoi numeri alla pubblicazione dei lavori che hanno costituito parte del
materiale didattico del Corso "Problemi Cardiologici in Anestesia e Terapia
Intensiva" tenutosi nel Marzo 2003 presso il CEFPAS (Centro per la Formazione
Permanente e l'Aggiornamento del Personale del Servizio Sanitario) sito in
Caltanissetta (Sicilia). Questo è uno dei corsi organizzati in collaborazione
con la FEEA (Fondazione Europea di Insegnamento in Anestesiologia) e rappresenta
uno dei diversi momenti formativi di un vasto percorso didattico che spazia
ampiamente tra le diverse aree di interesse nel campo dell'Anestesia e della
Terapia Intensiva.
In futuro Esia-Italia ospiterà altri iter formativi monotematici nella certezza
di incontrare la continua necessità di studio dei suoi Lettori che potranno così
soddisfare in modo sempre gratuito e immediato le proprie esigenze di formazione
anche non spostandosi dal proprio posto di lavoro.
dal Corso "PROBLEMI CARDIOLOGICI IN
ANESTESIA E TERAPIA INTENSIVA" - CORSO FEEA 2 - marzo 2003 CEFPAS
1 Raccomandazioni per la gestione perioperatoria del cardiopatico da sottoporre a chirurgia non cardiaca
2 Il cuore come
organo bersaglio dei tossici
_______________________________________________________
Raccomandazioni
per la gestione perioperatoria del
cardiopatico da sottoporre a chirurgia non cardiaca
_______________________________________________________
I.R.C.C.S.
Policlinico San Matteo, Pavia.
Testo di:
Dr. Nicoletta
Barzaghi, Dr. Piero Ceriana
-
Con
la collaborazione del Direttivo del
Gruppo di studio SIAARTI per l’Anestesia Cardiotoracica
Nel paziente con cardiopatia ischemica, l'esistenza di una stenosi coronarica fa sì che il miocardio si trovi talora in situazioni in cui l'ossigeno disponibile (apporto di ossigeno) è inferiore ai bisogni metabolici (consumo di ossigeno). Pertanto, il paziente coronaropatico tollera male le condizioni cliniche in cui si realizza uno sbilanciamento tra apporto e consumo di ossigeno, vale a dire gli stati di desaturazione arteriosa, di anemia, di ipotensione grave e gli stati iperdinamici [1].
Nel contesto della patologia coronarica vanno identificate differenti situazioni cliniche che si associano ad un profilo di rischio operatorio crescente a parità di intervento da eseguire [2-4]: l'angina stabile, l'angina instabile, l'infarto pregresso (occorso oltre otto settimane dall'intervento), recente (verificatosi entro cinque - otto settimane dall'intervento) e l'infarto acuto (occorso nei 30 giorni precedenti l'intervento). Tuttavia, prevalentemente in pazienti diabetici con disfunzione del sistema nervoso autonomo (compromissione del parasimpatico cardiaco), l'ischemia miocardica può verificarsi in assenza di angina; si configura così il quadro clinico dell'ischemia silente, il cui riconoscimento identifica una sottopopolazione di pazienti a rischio elevato di infarto e morte cardiaca improvvisa [5].
L'angina stabile è espressione di una stenosi coronarica fissa ed è caratterizzata da una soglia anginosa ben identificabile, mentre nell'angina instabile le lesioni coronariche sono concomitanti ad una spiccata vasoreattività che media un quadro clinico caratterizzato da un rapido progredire dei sintomi verso uno stato di male anginoso. In effetti, nella casistica di Shah et al., l'incidenza di IMA perioperatorio nei pazienti con angina instabile è del 28% [2].
Anche il tempo intercorso tra l'episodio infartuale e l'intervento di chirurgia non cardiaca permette di definire il rischio di reinfarto perioperatorio. Per quanto lo studio sia stato effettuato in epoca precedente l'impiego dei trombolitici nella terapia dell'infarto acuto, ed il valore dei dati ottenuti possa quindi non riflettere la realtà del momento attuale, il rischio di reinfarto è stato stimato del 27%, dell'11% e del 4% rispettivamente nei pazienti sottoposti ad intervento entro 3 mesi, nei 3-6 mesi e oltre 6 mesi da un pregresso infarto miocardico [3]. Un parere autorevole sull'argomento è stato recentemente espresso dall'American College of Physicians (ACP), che ha invitato a considerare a rischio aggiuntivo di reinfarto i pazienti sottoposti ad intervento di chirurgia non cardiaca nelle otto settimane successive ad un episodio infartuale [4].
Tra tutte le valvulopatie è particolarmente temibile la stenosi aortica [6]. Nella stenosi aortica, l'ostruzione critica al flusso e l'ischemia miocardica dovuta ad insufficiente perfusione coronarica possono condurre ad arresto cardiocircolatorio refrattario alle usuali manovre di rianimazione cardiopolmonare.
Nel casi di stenosi mitralica l'ipertensione del circolo polmonare e la diminuita compliance polmonare rappresentano le alterazioni fisiopatologiche più rilevanti. Nei pazienti con insufficienza mitralica e/o aortica, l'evenienza di bradicardia e l'aumento delle resistenze vascolari sistemiche aumentano la frazione di rigurgito; queste condizioni cliniche possono pertanto condurre ad un deterioramento dell'assetto emodinamico. Infine, nelle cardiopatie dilatative, la possibilità di scompenso emodinamico può dipendere da variazioni acute del precarico, da aumenti del postcarico e da fattori che deprimono ulteriormente la già compromessa contrattilità.
Valutazione
preoperatoria
La valutazione preoperatoria del cardiopatico da sottoporre ad intervento di chirurgia non cardiaca ha come principali obiettivi:
1. la definizione della natura, della gravità e delle ripercussioni che la cardiopatia comporta sull'organismo;
2. la stratificazione del rischio operatorio, in base alla gravità della cardiopatia e alla natura dell'intervento chirurgico;
3. la pianificazione di una strategia operativa in funzione del rischio.
L'anamnesi del paziente, l'analisi dei documenti clinici ed un accurato esame obiettivo rappresentano i momenti fondamentali della valutazione preoperatoria. Nella maggior parte dei pazienti, semplici domande consentono di definire la riserva funzionale cardiovascolare: in particolare, la capacità di salire almeno un piano di scale senza disturbi caratterizza una riserva funzionale come minimo moderata (³ 4 MET; MET = livello di equivalente metabolico) (Tabella 1). L'elettrocardiogramma (ECG) a riposo, il radiogramma del torace, un bilancio ematochimico completo (esame emocromocitometrico inclusivo di conta piastrinica, attività protrombinica e tempo di tromboplastina parziale, creatininemia, glicemia, sodiemia, potassiemia, cloruremia, calcemia) sono obbligatori nel paziente affetto da cardiopatia.
|
Tabella 1.
Richiesta energetica, espressa in livelli di equivalenti metabolici
(MET), |
|
|
1 MET
4 MET |
|
|
4 MET
10 MET |
|
| Oltre 10 MET |
|
I pazienti possono essere classificati in tre categorie in base alla presenza di fattori di rischio cardiovascolare definiti rispettivamente maggiori, intermedi e minori. Sono:
fattori di rischio maggiori:
sindromi coronariche instabili: infarto miocardico acuto (< 30 giorni) con evidenza clinica o strumentale di ischemia residua, angina instabile o invalidante;
insufficienza cardiaca scompensata;
valvulopatia grave;
aritmie gravi: blocco atrio-ventricolare di grado avanzato (blocco di II grado, Mobitz 2; blocco di III grado; blocco di conduzione bifascicolare e/o blocco atrioventricolare di II grado; tutti i disturbi di conduzione sintomatici), aritmie ventricolari sintomatiche, aritmie sopraventricolari con risposta ventricolare non controllata.
fattori di rischio intermedi:
angina stabile o controllata;
infarto miocardico pregresso;
insufficienza cardiaca compensata o pregresso scompenso cardiaco
diabete mellito.
fattori
di rischio minori:
età avanzata;
ECG anormale (blocco di branca sinistra, ipertrofia ventricolare sinistra, anomalie della ripolarizzazione, ritmo non sinusale);
ridotta capacità funzionale;
pregresso infarto cerebrale;
ipertensione arteriosa non controllata dalla terapia medica o non trattata.
Analogamente, gli interventi chirurgici possono essere distinti in tre gruppi in base al rischio cardiovascolare ad essi correlato.
Sono
interventi chirurgici:
ad alto rischio (classe A):
interventi maggiori in urgenza, specie nell'anziano;
interventi di chirurgia aortica e vascolare arteriosa periferica;
procedure chirurgiche prolungate e/o associate a importanti variazioni volemiche.
a rischio intermedio (classe B):
interventi di tromboendoarterectomia carotidea;
interventi di chirurgia toracica e addominale;
interventi chirurgici della testa e del collo;
procedure ortopediche;
interventi chirurgici della prostata.
a
rischio basso (classe C):
procedure endoscopiche;
procedure chirurgiche di superficie;
intervento di cataratta;
chirurgia della mammella
Identificati in ciascun paziente i fattori di rischio cardiovascolare e il rischio di complicanze cardiovascolari in relazione alla procedura chirurgica, le indicazioni fornite dall'AHA/ACC si possono schematicamente riassumere come segue:
1. A prescindere dalla natura dell'intervento chirurgico proposto, e purchè questo non rivesta carattere di emergenza, i pazienti con fattori di rischio maggiori necessitano di una valutazione cardiologica immediata che condurrà, nella maggior parte dei casi, ad una rivascolarizzazione miocardica o ad una chirurgia valvolare o ad una modificazione della terapia medica in atto.
2. I pazienti con fattori di rischio intermedi possono essere sottoposti ad intervento chirurgico di elezione senza indagini supplementari se la loro riserva funzionale è almeno moderata e l'intervento proposto è a rischio basso o intermedio. Qualora l'intervento sia a rischio elevato, e comunque quando la capacità funzionale è scarsa, è necessaria una valutazione cardiologica (Figura 1).
3. I pazienti con fattori di rischio minori possono essere sottoposti ad intervento chirurgico di elezione senza indagini supplementari, qualsiasi sia la natura dell'intervento programmato, se la loro riserva funzionale è almeno moderata e, in caso di scarsa capacità funzionale, se la chirurgia è a rischio basso o intermedio. In caso di chirurgia ad alto rischio e di scarsa capacità funzionale, è necessaria una valutazione cardiologica (Figura 1).
|
Figura 1.
Algoritmo diagnostico dell'AHA, nella sua
forma |
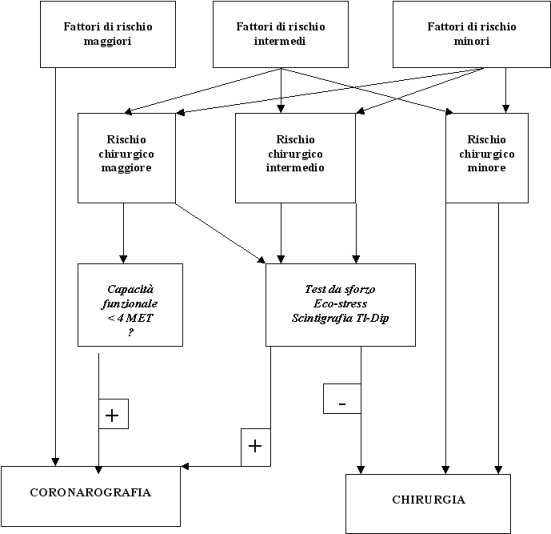 |
Da ultimo, in ogni paziente, una particolare cura va posta nell'individuazione e nell'ottimizzazione di quelle patologie non cardiache in grado di influenzare in modo decisivo il rischio cardiaco e operatorio, vale a dire l'anemia, la malattia polmonare cronica, l'epatopatia avanzata e l'insufficienza renale.
Il primo punto riguarda l'identificazione della classe di rischio cardiovascolare, necessaria per identificare in quali pazienti richiedere una valutazione cardiologica e l'esecuzione di indagini diagnostiche cardiologiche. Per la stratificazione del rischio viene proposta una scala a punteggio, il Cardiac Risk Index di Goldman modificato da Detsky [10] (Tabella 2). In relazione con il punteggio totale (compreso tra 0 e 100) ottenuto, i pazienti sono stratificati in tre classi di rischio con diversa probabilità di complicanze cardiache maggiori (Tabella 3).
|
|
|
| Tabella
2 Cardiac Risk Index di Goldman modificato da Detsky |
|
|
Variabile |
Punteggio |
|
Età > 70 anni |
5 |
|
Infarto miocardico nei 6 mesi precedenti l'intervento |
10 |
|
Infarto miocardico oltre i 6 mesi precedenti l'intervento |
5 |
|
Angina in classe III della Società Cardiovascolare Canadese |
10 |
|
Angina in classe IV della Società Cardiovascolare Canadese |
20 |
|
Edema polmonare nella settimana precedente l'intervento |
10 |
|
Edema polmonare acuto in anamnesi |
5 |
|
Ritmo cardiaco non sinusale o con extrasistolia atriale |
5 |
|
Più di 5 battiti extrasistolici ventricolari |
5 |
|
Stenosi aortica critica |
20 |
|
Condizioni generali scadenti ** o allettamento |
5 |
|
Intervento in emergenza |
10 |
|
** PaO2<60 mm Hg; PaCO2 >50 mm Hg; potassiemia <3 mEq/l; azotemia >300 mg/dl; creatininemia >3 mg/dl. |
|
|
Tabella
3 |
||
|
Punteggio |
Classe |
Probabilità
di complicanze cardiache maggiori |
|
0
-15 |
I |
0- 15% |
|
20 - 30 |
II |
20-30% |
|
> 30 |
III |
> 60% |
I pazienti in classe 2 e 3 sono considerati sicuramente a rischio elevato di complicanze cardiache perioperatorie.
Tuttavia, la possibilità di complicanze maggiori non può essere esclusa nei pazienti che hanno ottenuto un basso punteggio globale poiché l'accuratezza predittiva negativa del Cardiac Risk Index non è buona. Pertanto, i pazienti in classe 1 devono essere ulteriormente indagati per la presenza degli "indici di basso rischio” identificati da Eagle et al. [11] e da Vanzetto et al. [12] (Tabella 4).
Sono realmente a basso profilo di rischio i pazienti che non presentano nessuno o solo uno degli indici di basso rischio considerati. I pazienti a basso rischio di complicanze cardiache maggiori perioperatorie possono essere sottoposti all’intervento chirurgico elettivo senza ulteriori accertamenti diagnostici.
Nei pazienti in cui si identificano due o più criteri di basso rischio, il profilo di rischio deve essere considerato di entità intermedia. In questi pazienti è necessaria l'esecuzione di indagini ulteriori al fine di ristratificare il rischio di complicanze cardiache perioperatorie. Le indagini cardiologiche che consentono un'ulteriore stratificazione del rischio possono essere suddivise in tre categorie:
- metodiche che valutano la frazione di eiezione a riposo (ventricolografia ed ecocardiografia),
- test che evidenziano un'ischemia cardiaca inducibile (ergometria, test farmacologici)
- test che esplorano la funzione cardiaca a riposo e sotto sforzo (scintigrafia, eco-stress).
La valutazione della frazione d’eiezione a riposo non aggiunge alla valutazione clinica dati che contribuiscono alla ulteriore stratificazione del rischio; la ventricolografia (evidenza consistente) e l’ecocardiografia transtoracica (evidenza forte) non sono test idonei a stimare il rischio perioperatorio [13, 14].
Le indagini ergometriche non possono essere effettuate da molti pazienti (dal 30% al 70%) in lista per interventi di chirurgia vascolare e dai soggetti con alterata capacità di deambulare. In ogni caso, il potere predittivo dei test ergometrici è risultato basso [15,16].
La scintigrafia al tallio e/o l’eco-dobutamina, soprattutto nel caso di test negativo, consentono la ristratificazione del rischio nei pazienti inizialmente classificati a rischio intermedio e candidati ad intervento di chirurgia vascolare (evidenza forte), in cui la loro esecuzione è quindi consigliabile [12, 17]. Al contrario, non è evidente il vantaggio di sottoporre a scintigrafia o a eco-dobutamina pazienti a basso rischio candidati a chirurgia vascolare [11] e i pazienti rischio intermedio candidati a chirurgia non vascolare [18].
Il monitoraggio Holter non ha potere predittivo sul rischio nei pazienti candidati a procedure di chirurgia non vascolare (evidenza forte) [19]. Anche nei pazienti in lista per procedure di chirurgia vascolare, al momento attuale non esistono dati sufficienti a provare una reale utilità del test.
La coronarografia è un'indagine invasiva e rischiosa. L'esame coronarografico non può essere pertanto consigliato al solo fine della stratificazione del rischio perioperatorio. L'unica eccezione è rappresentata da quei pazienti in cui è necessario completare la diagnostica di una sospetta coronaropatia indipendentemente dall’intervento di chirurgia non cardiaca [20].
Complessivamente, il 20% dei pazienti sottoposti alla procedura di stratificazione del rischio rientra nella classe ad elevata probabilità di complicanze cardiache perioperatorie. Di questi, circa la metà sono pazienti inizialmente ritenuti a rischio intermedio e ristratificati nella classe di alto rischio.
|
Tabella
4 - Indici di basso
rischio |
|
| secondo Eagle et al. [11] | secondo Vanzetto et al. [12] |
|
Età
> 70 anni |
Età
> 70 anni |
|
Anamnesi
di angina |
Anamnesi
di angina |
|
Diabete
mellito |
Diabete
mellito |
|
Aritmie
ventricolari in anamnesi |
Onde
Q patologiche all'ECG |
|
Onde
Q patologiche all'ECG |
Anamnesi di scompenso
cardiaco |
|
|
Anamnesi di infarto
miocardico |
|
Alterazioni dell'ST
all'ECG standard |
|
|
Ipertensione con
criteri ECG di ipertrofia |
|
Una volta identificata la classe di rischio a cui un paziente appartiene è poi necessario identificare le strategie operative per minimizzare il rischio in ogni singolo paziente. Si possono riconoscere alcune situazioni paradigmatiche.
1) Il rischio è legato a fattori non modificabili quali l’età. Va considerata la possibilità di cambiare l'approccio chirurgico eseguendo, anziché un intervento radicale, un gesto palliativo o meno invasivo; in alcuni casi può essere opportuno escludere alcuna opzione chirurgica.
2) Il rischio è legato a patologia cardiaca non ischemica suscettibile di miglioramento (scompenso, aritmia, valvulopatia). In questo caso va in primo luogo ottimizzato il trattamento medico della cardiopatia; successivamente il rischio dovrà essere rivalutato.
3) Il rischio è legato ad una cardiopatia ischemica suscettibile di correzione chirurgica. La decisione sull'opportunità di procedere ad una rivascolarizzazione miocardica prima dell’intervento di chirurgia non cardiaca dipende da quanto la correzione della coronaropatia modifica la prognosi a breve e lungo termine.
Per quanto attiene alla prognosi a breve termine, al momento attuale non sono disponibili indagini prospettiche. Due indagini retrospettive mirate ad evidenziare se la prognosi a breve termine di pazienti sottoposti a chirurgia vascolare (ma le stesse conclusioni sono probabilmente estrapolabili anche per altre chirurgie ad elevato rischio di complicanze cardiache perioperatorie, quali quella addominale alta e toracica) è positivamente influenzata dalla precedente correzione chirurgica della patologia coronarica concludono che la riduzione del rischio di complicanze cardiache maggiori può essere tuttavia controbilanciata dal rischio proprio della procedura di bypass coronarico [20, 21].
Pur con i limiti di un'indagine retrospettiva, un recente lavoro di Gottlieb et al. [22], in cui veniva valutato come l'esecuzione di una rivascolarizzazione non chirurgica mediante angioplastica influenzava la prognosi a breve termine di pazienti ad alto rischio in lista per procedure di chirurgia vascolare, giunge a conclusioni differenti. I pazienti sottoposti ad angioplastica prima della chirurgia vascolare, infatti, presentavano un'incidenza di complicanze cardiache perioperatorie inferiori rispetto a pazienti con profilo di rischio similare non sottoposti a rivascolarizzazione. Questi dati meritano di venire confermati da indagini prospettiche in quanto l'angioplastica, efficace nel risolvere l'angina ma meno costosa e meno rischiosa rispetto al bypass coronarico, potrebbe rappresentare un'opzione valida per ridurre il rischio di complicanze cardiache nei candidati a procedure chirurgiche non cardiache, tanto più se si considera il fatto che dopo angioplastica è possibile procedere all'intervento di chirurgia non cardiaca in tempi contenuti.
Per quanto riguarda i benefici a lungo termine del bypass coronarico prima dell’intervento di chirurgia non cardiaca, esiste una forte evidenza a favore della rivascolarizzazione per i pazienti con angina instabile refrattaria alla terapia medica massimale, con stenosi del tronco comune, con malattia trivasale e depressa funzione miocardica, con malattia bivasale ma stenosi critica prossimale della discendente anteriore e disfunzione ventricolare sinistra [23].Questi stessi pazienti rientrano in quella categoria di cardiopatici in cui, secondo le linee guida dell’ACC/AHA, sarebbe indicato procedere a bypass coronarico indipendentemente dal problema contingente dell’intervento di chirurgia non cardiaca. Tuttavia, mancando uniformità di consenso ed evidenza sul timing ottimale dell’intervento di bypass rispetto a quello non cardiaco pare preferibile decidere non sulla base di protocolli standardizzati ma, in ogni singolo caso, in base alla gravità della coronaropatia, all'urgenza dell’intervento non cardiaco e - non ultimo- al parere del paziente debitamente informato.
Aspetti generali sull’impiego dei farmaci cardiovasoattivi
Il paziente cardiopatico è per lo più in terapia medica cronica, basata sull’impiego combinato di uno o più farmaci cardiovasoattivi e, nella maggior parte dei casi, di farmaci che agiscono sull’emostasi (Tabella 5).
Ad eccezione dei pazienti in compenso cardiocircolatorio precario, talora in terapia endovenosa, i farmaci cardiovasoattivi vengono generalmente somministrati per via orale. Per alcuni principi attivi (nitroderivati, a2-agonisti) sono anche disponibili formulazioni a cessione transdermica, di uso piuttosto diffuso. L’assorbimento di questi medicamenti, somministrati per via orale o transdermica, è prevedibile solo se è mantenuta l’integrità anatomica e funzionale della via di assorbimento, cosa che non sempre si verifica nel periodo perioperatorio, anche nel caso in cui la sede dell’atto chirurgico non sia l’apparato gastroenterico o muscolo tegumentario: basti pensare alla frequenza con cui si verificano nel postoperatorio alterazioni funzionali del transito intestinale (ileo, vomito) e fenomeni di ipoperfusione cutanea.
Pertanto, e soprattutto nei pazienti con compenso più labile, è opportuno pianificare preventivamente tipo, dose, via e modalità di somministrazione dei farmaci cardioattivi da utilizzare nel periodo perioperatorio.
|
Tabella
5 |
|
|
|
|
|
Antianginosi |
a.
Farmaci attivi sul sistema cardiovascolare b-bloccanti;
calcio-antagonisti; nitroderivati; |
|
Antipertensivi |
ACE-inibitori; a2-agonisti;
diuretici; |
|
Antiaritmici |
di classe Ia: chinidina,
disopiramide, procainamide; di classe Ib: lidocaina,
mexiletina, tocainide di classe III:
amiodarone; |
|
Inotropi |
Digitale amine simpaticomimetiche inibitori della
fosfodiesterasi III |
|
Anticoagulanti |
b.
Farmaci attivi sull’emostasi dicumarolici; eparine; |
|
Antiaggreganti |
acido acetilsalicilico; dipiridamolo;
indobufene; picotamide monoidrata; ticlopidina |
Per quanto riguarda la scelta del medicamento, non per tutti i farmaci è disponibile sia la formulazione orale che parenterale: è il caso di diversi beta-bloccanti e degli ACE-inibitori, che devono essere sostituiti con farmaci a profilo farmacodinamico, almeno ad effetto cardiovascolare, similare.
Quanto alla dose, la biodisponibilità di molti medicamenti dati per via orale è incompleta. Pertanto, le dosi da impiegare per uso endovenoso possono essere inferiori rispetto a quelle somministrate per via enterale: è questo il caso del propranololo e dei calcio-antagonisti.
Con l’eccezione di alcuni farmaci (nitroglicerina, nifedipina), che vengono assorbiti rapidamente attraverso la mucosa sottolinguale e possono essere somministrati d’urgenza rispettivamente in occasione di crisi anginose e di crisi ipertensive, la via di somministrazione di scelta dei medicamenti cardiovasoattivi nel periodo perioperatorio è quella endovenosa. La somministrazione endovenosa consente infatti di prescindere dalla variabilità nella risposta al farmaco dovuta all’alterazione dei processi di assorbimento, di individuare esattamente la dose di farmaco che produce l’effetto desiderato e di mantenere tale effetto costante mediante infusione endovenosa. Tali obiettivi possono essere raggiunti quando la somministrazione dei farmaci cardiovasoattivi viene effettuata con precisione, vale a dire mediante pompe infusionali in vie venose dedicate. A questo proposito, per quanto consigliabile nei pazienti con compenso labile, non esistono dati certi a supporto della pratica di incannulare sistematicamente un vaso venoso centrale al fine di infondere farmaci.
E’ comunque sconsigliabile l’infusione di più farmaci cardiovasoattivi in un unico condotto venoso utilizzando prolunghe e raccorderie, come pure l’infusione in una stessa linea venosa di farmaci cardiovasoattivi e liquidi di riempimento. In entrambi i casi, modificare la velocità di infusione di una soluzione significa modificare la velocità di somministrazione del volume di liquido (e ovviamente la quantità di farmaco) che è contenuto distalmente al raccordo, cosa che può causare alterazioni emodinamiche tanto più gravi quanto maggiore è la concentrazione dei farmaci in soluzione.
Come ultima osservazione di carattere generale va ricordato che l'impiego della via intramuscolare deve essere considerato con cautela nei pazienti in terapia anticoagulante - e molti pazienti cardiopatici lo sono - per il rischio di ematomi nel punto di iniezione.
Aspetti specifici sulla terapia con farmaci cardiovasoattivi
Esiste consenso nel ritenere che un paziente ben compensato sul piano clinico grazie ad una terapia medica adeguata sia nelle condizioni migliori per reggere lo stress del periodo perioperatorio e che, al fine di garantire un compenso clinico ottimale, la terapia assunta cronicamente debba essere continuata perioperatoriamente.
Di fatto, non sono note interazioni tra farmaci cardiovasoattivi ed anestetici di entità tale da rendere necessaria la sospensione preoperatoria dei primi. Al contrario, è stato dimostrato che la sospensione dei medicamenti cardiovasoattivi può essere associata ad alterazioni emodinamiche [24, 25].
Quanto alla somministrazione della terapia prima dell’intervento, l’assunzione di acqua nell’ora precedente l’induzione dell’anestesia è da ritenersi sicura nei pazienti senza patologie dell’apparato gastroenterico. Pertanto, la terapia può essere assunta per via orale alle dosi abituali prima dell’intervento.
Quanto alla somministrazione della terapia dopo l’atto chirurgico, nel caso in cui questo non comporti o non si accompagni ad alterata funzionalità gastrointestinale ed il paziente sia ben collaborante, la terapia potrà essere assunta come di consueto. Nel caso invece in cui la via enterale sia preclusa, è necessario considerare altre modalità di assunzione dei medicamenti cardiovasoattivi per evitare la ripresa della sintomatologia cardiologica (in relazione al naturale esaurimento dell’effetto terapeutico dei farmaci precedentemente assunti) e/o l’insorgenza di sindromi da sospensione. Queste ultime, descritte per gli a2-agonisti e i b-bloccanti, si manifestano come crisi ipertensive con tachiaritmie, che a loro volta causano ischemia miocardica.
A tutt’oggi, gli studi mirati ad evidenziare una possibile relazione tra mantenimento o sospensione della terapia cardiovasoattiva ed incidenza di complicanze cardiovascolari perioperatorie in popolazioni a rischio sono pochi ed esclusivamente limitati a soggetti con cardiopatia ischemica, che è di gran lunga la cardiopatia più frequente. A dispetto del numero esiguo, i risultati che emergono da tali studi sono rilevanti sul piano clinico.
Per quanto attiene ai b-bloccanti - e all'acido acetilsalicilico -, è stato dimostrato (evidenza forte) che l'incidenza e la gravità dell'ischemia miocardica perioperatoria è significativamente inferiore nei pazienti coronaropatici o con fattori di rischio per coronaropatia che giungono all’intervento di chirurgia non cardiaca con la terapia b-bloccante mantenuta fino all’immediato preoperatorio e ripresa precocemente nel postoperatorio [26]. L'azione cardioprotettiva dei b-bloccanti è conseguente all'effetto inotropo e cronotropo negativo che, limitando la risposta cardiaca in contrattilità e frequenza allo stimolo algogeno, riduce il consumo di ossigeno del miocardio, di cui al tempo stesso migliora la perfusione.
A fronte dei benefici enunciati, la terapia perioperatoria con b-bloccanti non è esente da rischi iatrogeni, specie in contesti clinici complessi (pazienti con riserve limitate in condizioni critiche). L'impossibilità ad aumentare la portata cardiaca per effetto della terapia b-bloccante può infatti condurre a non soddisfare le richieste tessutali, specialmente quando coesistono anemia, ipovolemia, febbre, stati di ipercatabolismo. Ove possibile, una opportuna correzione di tali condizioni , unitamente alla messa in atto di un monitoraggio emodinamico adeguato, diventa di importanza determinante.
Per quanto raccomandata, la somministrazione perioperatoria di calcio antagonisti e nitrati non risulta essere associata ad un effetto preventivo sull'ischemia perioperatoria evidente quanto quello emerso per i b-bloccanti. Questo verosimilmente a ragione del meccanismo stesso d'azione di questa classe di medicamenti. Nei pazienti in terapia con calcio-antagonisti e nitrati, infatti, la risposta in frequenza cardiaca allo stimolo simpatico può non essere marcatamente depressa. Lo stimolo algogeno può quindi essere responsabile di uno squilibrio acuto tra apporto e consumo di ossigeno, con conseguente ischemia.
In questo contesto, l'impiego perioperatorio degli a2-agonisti potrebbe trovare uno spazio proprio, tanto più se si considera il fatto che questi medicamenti sono provvisti d'azione sedativa, ansiolitica ed analgesica e limitano l'entità del brivido postoperatorio, che comporta rilevante consumo di ossigeno [27].
Considerazioni particolari vanno fatte in merito all'impiego perioperatorio di ACE-inibitori, una classe di farmaci largamente utilizzati in pazienti con ipertensione arteriosa e con deficit di pompa cardiaca. In pazienti ipertesi trattati con ACE-inibitori, l’induzione della narcosi si può accompagnare a severi episodi ipotensivi, talora correggibili solo ricorrendo a farmaci vasopressori. Per questo motivo alcuni Autori consigliano, nel preoperatorio, di sospendere l'ACE-inibitore, sostituendolo con antipertensivi di altra classe farmacologica. I tempi minimi consigliati di sospensione dell’ACE-inibitore prima di un intervento chirurgico sono di 12 h per il captopril e il quinapril e di 24 h per l'enalapril, il linosipril e il ramipril [28]. Ammesso che la sospensione dell'ACE-inibitore possa essere ritenuta praticabile nel contesto di una cardiopatia ipertensiva, bisogna riflettere sull'opportunità di tale comportamento nei pazienti con funzione contrattile depressa, in cui l'ACE-inibitore è il vasodilatatore più largamente utilizzato. In questi pazienti infatti un aumento del postcarico può accompagnarsi a scompenso cardiocircolatorio acuto. L'esperienza maturata su pazienti in attesa di trapianto cardiaco sottoposti a procedure di chirurgia non cardiaca consente di affermare che il trattamento perioperatorio dei soggetti in precario compenso cardiocircolatorio non può essere standardizzato ma deve, in ogni singolo caso, essere guidato dal monitoraggio emodinamico (vedi oltre).
Sebbene gli antiaritmici di classe Ia e Ib interferiscano con i curari non depolarizzanti (prolungandone la durata d'azione), l'eventuale terapia antiaritmica in corso deve essere mantenuta nel periodo perioperatorio per evitare la ripresa delle aritmie. Per quanto siano stati riportati casi di ipotensione refrattaria, bradicardia resistente all'atropina e dissociazione atrioventricolare nei pazienti in trattamento con amiodarone [29], la sospensione di tale terapia nel preoperatorio è inopportuna per ragioni cliniche (ripresa delle aritmie) e farmacocinetiche (il tempo di emivita dell'amiodarone è pari a 29-100 giorni).
Per quanto attiene ai pazienti in trattamento endovenoso continuo con inotropi, nel perioperatorio, l’infusione di questi farmaci non va sospesa ma ottimizzata. A tal fine, il monitoraggio emodinamico (vedi oltre) è necessario. L’induzione della narcosi può associarsi a ipotensione (da deficit contrattile del cuore) con ipoperfusione, contenibile in parte somministrando gli anestetici lentamente, alle dosi minime possibili per ottenere l’effetto desiderato e tenendo conto del fatto che la latenza dell’effetto può essere marcatamente aumentata. Nel corso dell’intervento, le variazioni volemiche acute vanno contrastate e prontamente corrette. Allo stesso modo devono essere corrette le disionie, che possono causare gravi turbe del ritmo cardiaco.
Aspetti specifici sulla terapia con farmaci attivi sull'emostasi
La maggioranza dei pazienti coronaropatici è in terapia antiaggregante, generalmente con acido acetilsalicilico a basse dosi o ticlopidina, più raramente con dipiridamolo, indobufene o picotamide monoidrato.
Come per i b-bloccanti, anche l'acido acetilsalicilico va continuato nel perioperatorio in quanto il suo impiego è associato ad una minore incidenza di ischemia miocardica in assenza di un sostanziale aumento del sanguinamento chirurgico [24].
Malauguratamente, anche bassi dosaggi di aspirina possono causare gastropatia erosiva, il che giustifica la pratica di istituire una gastroprotezione farmacologica sistematica in tutti i pazienti in terapia antiaggregante con aspirina, indipendentemente da ogni contesto perioperatorio [30].Durante il periodo perioperatorio, che rappresenta una causa indipendente di stress per l'organismo, l'impiego di gastroprotettori, raccomandato in linea generale, è da ritenersi necessario nei soggetti in terapia con salicilati.
La ticlopidina è l’antiaggregante di scelta nei pazienti intolleranti e/o allergici all'aspirina. L'effetto antiaggregante persiste per oltre 8 giorni dopo l'interruzione del farmaco. A tutt'oggi, la gestione della terapia con ticlopidina nel periodo perioperatorio non è codificata. Per una chirurgia elettiva, sembrerebbe prudente sospendere la terapia con ticlopidina [31, 32]. Per procedure d'urgenza, rimane dubbia l'efficacia della terapia steroidea e di desmopressina; nel caso di rischio emorragico rilevante, probabilmente è preferibile la trasfusione di concentrati piastrinici [32].
In considerazione del numero limitato di pubblicazioni pertinenti, non è possibile identificare linee guida in merito alla gestione perioperatoria della terapia antiaggregante con dipiridamolo, indobufene e picotamide.
Sebbene qualche caso di ematoma epidurale dopo anestesia loco-regionale sia stato descritto in pazienti antiaggregati con aspirina o antinfiammatori non steroidei, l’incidenza di tale complicanza non pare essere significativamente maggiore nei pazienti trattati con aspirina rispetto a quelli non in terapia antiaggregante [33]. E' quanto emerge da dati ottenuti in studi clinici retrospettivi e prospettici condotti, nei primi anni novanta, su larghe casistiche di pazienti antiaggregati con aspirina, in cui pertanto la possibilità di un'anestesia loco-regionale non deve ritenersi preclusa dalla terapia antiaggregante [24]. Studi simili non risultano essere stati finora effettuati su popolazioni trattate con ticlopidina, a cui non pare corretto estendere le conclusioni emerse per l’aspirina.
La gestione del paziente in terapia anticoagulante nel periodo perioperatorio di una chirurgia non cardiaca è estremamente difficile per la complessità intrinseca della materia e per la contemporanea esigenza di:
1. effettuare l'atto chirurgico in presenza di un assetto coagulativo quasi normalizzato, per limitare il rischio di complicanze emorragiche da eccessiva anticoagulazione (in corso di intervento o nell'immediato postoperatorio);
2. limitare al minimo necessario il periodo con assetto coagulativo ai limiti della norma per evitare l'insorgenza di complicanze tromboemboliche.
E’ nostra convinzione che una gestione ottimale della terapia anticoagulante nel periodo perioperatorio sia uno degli elementi centrali nell’assistenza al malato cardiopatico. Un approccio razionale alla gestione della terapia anticoagulante, che può essere opportuno e preferibile concordare – a seconda delle diverse realtà operative – con l’internista o con specialisti nel campo dell’emostasi e trombosi, deve tener conto:
1. dei fattori che motivano la necessità dell'anticoagulazione nel singolo paziente (Tabella 5),
2. dell'atto chirurgico cui il paziente deve essere sottoposto (Tabella 6),
3. del rischio relativo di tromboembolia e di sanguinamento rispettivamente in corso di anticoagulazione perioperatoria completa e subottimale,
4. degli strumenti di cui il medico dispone per modificare l'assetto coagulativo in relazione con lo specifico contesto clinico (Tabella 7) [24, 34-38].
L'impiego dell'eparina viene limitato a brevi periodi di trattamento mentre la terapia anticoagulante cronica è basata sulla somministrazione per via orale di dicumarolici. In Italia sono commercializzate due dicumarolici, l'acenocumarolo (Sintromâ) e la warfarina (Coumadinâ), tra loro differenti per caratteristiche farmacocinetiche. Il tempo di emivita dell'acenocumarolo è infatti inferiore a quello della warfarina, di cui è pertanto più prolungata la durata dell'effetto farmacologico dopo la riduzione della posologia o la sospensione della terapia.
|
Tabella
6 - Fattori da
considerare nel paziente in terapia anticoagulante orale (TACO) da
sottoporre a chirurgia non cardiaca
|
|
|
a.
Fattori inerenti alla cardiopatia:
motivo per cui il paziente è in
TACO |
|
|
Fibrillazione
atriale (unico fattore) |
Il
rischio di sanguinamento facendo l'intervento in scoagulazione è
maggiore del rischio di stroke: la sospensione dell'AC può essere
accettabile e va ponderata in ogni singolo caso. |
|
Valvulopatia
reumatica su mitrale nativa, con atriomegalia sinistra e/o fibrillazione
atriale |
La
TACO cronica è necessaria; la terapia eparinica perioperatoria,
limitata ai periodi in cui INR<2, va riservata ai pazienti ad alto
rischio di complicanze emboliche (stroke nel mese precedente la
chirurgia) a dispetto del maggior sanguinamento. |
|
Protesi valvolare |
Biologica:
la TACO è necessaria solo nei primi 3 mesi dopo impianto. Meccanica:
anticoagulazione obbligatoria per sempre: il passaggio alla terapia
eparinica nel perioperatorio è necessario. |
|
b.
Fattori inerenti alla chirurgia non cardiaca nel portatore di protesi
valvolari meccaniche |
|
|
Chirurgia
maggiore, indifferibile (es:
politramatizzato con emorragia interna) |
Vitamina
K1 e.v. (2.5-5 mg, lentamente) ed eventualmente trasfusioni
di plasma fresco congelato per contrastare l'emorragia |
|
Chirurgia maggiore, differibile di 24 h |
Vitamina
K1 (1 mg, p.o. oppure 0.5 -1 mg i.v.) generalmente riduce
l'INR da ~4.0
a ~1.5
in ~24
h nei pazienti in terapia con warfarina; nel postoperatorio, trattamento
standard (vedi testo) |
|
Chirurgia maggiore, elettiva |
Prima
dell'intervento, interruzione della TACO e sostituzione con terapia
eparinica in infusione endovenosa (vedi testo) |
|
Chirurgia minore, elettiva
(es: avulsione dentaria, biopsia cutanea) |
Paziente in terapia con acenocumarolo: stop
Sintrom per ~24
h (così che 1.5<INR<2) prima della procedura; subito dopo la fine
della procedura assumere la dose standard di farmaco.
Paziente in terapia con warfarina: unica
dose orale di vitamina K1 (*) da assumere 36 h prima della
procedura continuando ad assumere la dose standard di warfarina; al
momento della procedura, INR sarà pari a ~
1.75. |
|
* Formula per
calcolare la dose di vitamina k1 da assumere p.o. così da
portare l'INR al momento della procedura al valore di 1.75: 16 - [17 x
(1.75/INR in terapia)], dove INR in terapia è compreso tra 2.5 e 4.9 |
|
In previsione di una chirurgia maggiore elettiva o differibile, il dicumarolico va interrotto e sostituito con un'appropriata terapia eparinica [34].
Nel paziente in range ottimale di anticoagulazione, la somministrazione di eparina deve iniziare quando l'INR è di poco superiore a 2, vale a dire circa 24 h dopo l'ultima somministrazione di Sintromâ e circa 36 h dopo l'ultima somministrazione di Coumadinâ. La terapia eparinica, titolata al raggiungimento di un aPTT ratio di 2-2.5, deve proseguire fino a regressione dell'effetto dei dicumarolici. Tenendo conto dell'emivita dei dicumarolici e ammettendo che l'INR del paziente sia circa 3, il tempo necessario alla normalizzazione dell'INR è generalmente inferiore a 48 h per l'acenocumarolo e di 3-5 giorni per la warfarina.
Per quanto riguarda la via di somministrazione dell'eparina, nel periodo preoperatorio l'infusione continua endovenosa sembra essere preferibile alla via sottocutanea (che è pur sempre praticabile!) probabilmente per la migliore titolabilità della dose in relazione all'effetto.
L'eparina deve essere sospesa prima dell'atto chirurgico, che può essere eseguito in sicurezza quando il valore di aPTT è prossimo al range di normalità. In relazione con la cinetica del farmaco dato rispettivamente per via endovenosa e sottocutanea, il tempo necessario a normalizzare l'aPTT dopo sospensione dell'eparina è generalmente pari a 2-4 h nel caso dell'infusione endovenosa e a 12-14 h dopo somministrazione sottocutanea.
Il ripristino della terapia anticoagulante con eparina subito dopo la fine dell'atto chirurgico è gravato da un rischio elevato di complicanze emorragiche: il 3% dei pazienti trattati per 2 giorni con eparina e.v. presentano complicanze emorragiche, mortali ocon sequele nel 3% dei casi [34]. L'opportunità di iniziare la terapia eparinica nel postoperatorio va quindi stabilita dopo aver valutato, in ogni singolo paziente, il rischio relativo di complicanze emorragiche ed emboliche. Sugli aspetti concreti di tale valutazione tuttavia non esiste reale uniformità di giudizio tra gli esperti [34, 36]. Sebbene gravata dal rischio di sanguinamento, secondo Tavel e Stein [36], la terapia eparinica dovrebbe essere ripresa non appena il rischio di sanguinamento può essere considerato ragionevolmente ridotto nei pazienti con protesi valvolare meccanica in posizione mitralica, in cui il rischio di complicanze emboliche è verosimilmente più elevato che nei pazienti con protesi valvolari aortiche o con fibrillazione atriale senza complicanze emboliche nel mese precedente la chirurgia. Proprio in considerazione del rischio emorragico, in queste due ultime categorie di pazienti, se sottoposti a chirurgia che non preclude l'impiego della via enterale oltre il giorno dell'intervento, lo stesso Autore considera ragionevole non riprendere l'infusione di eparina ma iniziare l'anticoagulante orale non appena si possa escludere una causa chirurgica di sanguinamento. L'Autore non precisa se in questi pazienti, nell'attesa di raggiungere un INR adeguato, sia necessario somministrare eparina nelle dosi impiegate per la profisassi della trombosi venosa profonda. Tale comportamento è invece raccomandato da Kearon e Hirsh [34].
Al momento di reintrodurre la terapia con anticoagulanti orali, vale a dire una volta ripristinata una regolare attività peristaltica, la terapia eparinica e dicumarolica devono essere effettuate al contempo nei primi 3-5 giorni di terapia. In pratica, la terapia eparinica può essere sospesa solo dopo il ritorno dell'INR nei limiti del range terapeutico di anticoagulazione. Vale la pena ricordare che l'eparina agisce da anticoagulante solo quando la concentrazione ematica di antitrombina III è adeguata e che condizioni cliniche spesso riscontrabili nel perioperatorio (insufficienza epatica, stati settici) si associano a deficit di antitrombina III.
Per una chirurgia minimamente invasiva di tipo elettivo, una strategia attuabile può consistere nel diminuire il livello di anticoagulazione limitatamente al breve intervallo di tempo necessario ad effettuare la procedura chirurgica (Tabella 6).
Nel caso di chirurgia indifferibile, nel paziente totalmente anticoagulato con eparina, l'eparina può essere antagonizzata mediante somministrazione di protamina solfato, effettuata in boli endovenosi ripetuti monitorizzando il valore di aPTT o il tempo di coagulazione attivato (ACT). Contrariamente a quanto si verifica per l'eparina, non esiste la possibilità di antagonizzare i dicumarolici. Nel contesto di complicanze emorragiche pericolose per la vita e di chirurgia maggiore indifferibile è clinicamente accettabile la somministrazione di vitamina K1 e di plasma fresco congelato.
Secondo Smith
[24], in relazione al rischio emorragico, nel paziente in terapia anticoagulante
l'anestesia loco-regionale è una tecnica relativamente controindicata e
la decisione in merito alla continuazione o alla sospensione della terapia
eparinica finalizzata all'esecuzione di un'anestesia loco-regionale deve essere
presa in base al rapporto rischio-beneficio in ogni singolo paziente. Qualora
l'anestesia loco-regionale venga ritenuta preferibile ad altre tecniche di
anestesia, è raccomandabile dar corso alla procedura anestesiologica solo dopo
normalizzazione dei parametri coagulativi.
|
Tabella
7 - Anticoagulanti |
||
|
Parametro |
Eparine |
Anticoagulanti orali |
|
Farmaci |
E.
non frazionata sodica e calcica (ENF) E.
a basso peso molecolare (EBPM) |
Acenocumarolo
(Sintrom) Warfarina
(Coumadin) |
|
Meccanismo
dell'azione anticoagulante |
ENF:
Promuove in modo prevalente l'inibizione della trombina da parte
dell'antitrombina III (che non deve essere insufficiente!); EBPM:
Inibiscono in modo prevalente il fattore X attivato e quindi la
conversione della protrombina in trombina (il livello di antitrombina
non deve essere insufficiente!) |
-
dei fattori della coagulazione II, VII, IX , X; -
della proteina C e S |
|
Valutazione
dell'effetto |
ENF:
variazione dell'aPTT ratio EBPM:
test per uso clinico non diffuso |
Variazione
dell'attività protrombinica espressa come INR |
|
Anticoagulazione |
ENF:
2.0<aPTT ratio<2.5 |
2.5<INR<4.0 |
|
Via
di somministrazione |
ENF
sodica: endovenosa (boli o infusione) ENF
calcica: sottocutanea, 2-3 boli/die |
Orale
(unica somministrazione giornaliera) |
|
|
|
L'assorbimento
orale è relativamente prevedibile, nel singolo paziente, solo |
|
|
ENF
e.v.: azione immediata ENF
s.c.:30'-120' (perfusione e temperatura) |
Sintrom:
inizio dopo 8-12 h; picco: 24-36 h |
|
|
ENF
e.v.: 3-4 h (paziente normotermico) |
Sintrom:
24-36 h |
|
|
ENF:
protamina solfato, nella dose di 1mg/100 UI di eparina (efficacia
immediata) |
|
|
Complicanze
[35] |
|
|
Gestione
intraoperatoria del cardiopatico nell'ambito della chirurgia non cardiaca
Considerazioni specifiche alla luce della patologia di base
Per quanto
attiene alle competenze dell'anestesista, la presa in carico del cardiopatico
inizia con l'esame clinico, il colloquio col paziente e la prescrizione della preanestesia.
Obiettivo della premedicazione è indurre una modesta sedazione e ridurre
l'ansia (e lo stato iperdinamico che ad essa si associa) senza tuttavia causare
eccessiva sedazione e depressione respiratoria. Questi obiettivi sono
generalmente soddisfatti utilizzando blande dosi di benzodiazepine, che al
momento rappresentano la classe di farmaci di impiego più comune in
premedicazione. In contesti particolari (pazienti cardiopatici e ipertesi,
candidati ad interventi di chirurgia vascolare) può essere opportuno utilizzare
un farmaco ad azione a2-agonista
in alternativa o in associazione con le benzodiazepine [39]
Coronaropatie. Nei pazienti con angina stabile o precedentemente sottoposti a bypass aortocoronarico o angioplastica, come precedentemente detto, l'obiettivo perioperatorio è evitare valori estremi di pressione arteriosa e di frequenza cardiaca. Tuttavia, poichè episodi ischemici possono talora verificarsi anche in assenza di fattori causali immediatamente evidenti, è importante mettere in atto un monitoraggio emodinamico adeguato.
Nei pazienti con angina a bassa soglia, con angina instabile o infarto recente va valutata la possibilità di trattare la coronaropatia prima di effettuare l'intervento di chirurgia non cardiaca. Nel caso in cui questo rivesta carattere d'urgenza o d'emergenza e sia un intervento ad elevato rischio di complicanze cardiache (es: chirurgia vascolare) è da considerare la messa in atto di un monitoraggio emodinamico ed è da valutare, anche in relazione con la realtà operativa in cui l'anestesista si trova ad operare, la possibilità di utilizzare perioperatoriamente la contropulsazione aortica.
Valvulopatie. Indipendentemente dal tipo di valvulopatia, i pazienti valvulopatici candidati ad interventi di chirurgia non cardiaca devono effettuare la profilassi antibiotica dell'endocardite infettiva [40].
Per quanto attiene alla gestione emodinamica perioperatoria, nei pazienti con insufficienza valvolare è opportuno correggere i fattori che esacerbano la frazione di rigurgito (bradicardia e vasocostrizione sistemica).
Nei pazienti con stenosi aortica in classe non chirurgica (cioè con gradiente transvalvolare aortico di picco < 50 mm Hg e frazione di eiezione del ventricolo sinistro buona), gli obiettivi da soddisfare sono: il mantenimento di un ritmo sinusale con frequenza compresa tra 65 e 90 battiti/minuto, il mantenimento di una volemia normale e di resistenze sistemiche medio-alte. L'ipotensione, specie diastolica, e la tachicardia vanno prontamente corrette. Nei pazienti con stenosi aortica critica, la correzione della valvulopatia mediante sostituzione valvolare o valvulotomia percutanea deve precedere, ove possibile, l'esecuzione dell'intervento di chirurgia non cardiaca. Se questo non fosse differibile, nel contesto clinico di edema polmonare franco o pre-edema, si può considerare la possibilità di una contropulsazione aortica perioperatoria. Va da sé che questa misura terapeutica può essere praticata solo in contesti particolari, vale a dire laddove esista un buon rapporto di collaborazione con il consulente cardiologo e vi sia concretamente la disponibilità di un contropulsatore aortico.
Anche nei pazienti con stenosi mitralica serrata la correzione della valvulopatia dovrebbe precedere, ove possibile, l'esecuzione dell'intervento di chirurgia non cardiaca. Nelle stenosi mitraliche, anche in classe non strettamente chirurgica (cioè con area mitralica >1.5 cm2) sono spesso presenti fibrillazione atriale (cronica o parossistica), ipertensione polmonare e sovraccarico ventricolare destro. Il ritmo sinusale è importante per il compenso emodinamico. Tuttavia, nei pazienti in fibrillazione atriale cronica, il ripristino del ritmo sinusale mediante cardioversione elettrica o farmacologica è spesso impossibile. In questi soggetti, pertanto, la fibrillazione atriale va accettata. Nel caso in cui la frequenza di risposta ventricolare sia molto elevata, è tuttavia giustificato intervenire farmacologicamente, poichè solo la riduzione della frequenza ventricolare consente un riempimento ventricolare adeguato, da cui dipende criticamente la portata cardiaca. Nel paziente con stenosi mitralica è poi necessario mantenere normale la volemia, contrastare l'eccessiva vasodilatazione sistemica ed evitare (o correggere) gli stati di ipossiemia, ipercapnia e acidosi metabolica che aumentano i valori di pressione polmonare, già elevati in questa patologia.
Cardiopatie dilatative. Nei pazienti con cardiopatia dilatativa vanno valutate l'eziologia della cardiopatia di base (cardiopatia idiopatica, post-ischemica, valvolare, post-chemioterapica), il grado di compenso e la riserva funzionale del paziente.
L'intervento, dove non esistano condizioni cliniche che ne rendono inopportuno il differimento, deve aver luogo dopo il raggiungimento delle condizioni di compenso cardiovascolare migliori possibili con la terapia medica. L'obiettivo perioperatorio è evitare brusche cadute del precarico, repentini aumenti del postcarico e le situazioni, anche iatrogene, che deprimono la già scadente contrattilità.
Pazienti portatori di pace-maker e dispostitivi antiaritmici [41]. Noto il motivo per cui è stato impiantato uno stimolatore endocavitario (tipo di bradiaritmia), se ne devono conoscere tipo (stimolatore monocamerale o bicamerale) e modalità di programmazione (stimolazione fissa o demand; soglia di stimolazione e frequenza di stimolazione). Nel caso di interventi di chirurgia maggiore in pazienti totalmente dipendenti da pace-maker oppure di interventi in cui si prevede estensivo uso di bisturi elettrico, può essere opportuno riprogrammare lo stimolatore da modalità demand (VVI) a fissa (VOO) ed aumentare la frequenza di stimolazione. Generalmente i pace-maker vengono impostati a 70-75 battiti/minuto. Tale frequenza tuttavia può non essere sufficiente a garantire l'incremento di portata cardiaca desiderabile nel corso dell'intervento chirurgico e nel postoperatorio. Nel caso in cui la riprogrammazione non sia possibile, va considerata la possibilità di posizionare un elettrostimolatore endocavitario flottante.
Un problema particolare è rappresentato dall'interferenza del bisturi elettrico nel funzionamento del pace-maker e dei defibrillatori impiantabili.
Per ridurre l'entità dell'interferenza tra pace-maker ed elettrobisturi è necessario impiegare elettrocauteri bipolari (anziché unipolari), limitandone l'uso a brevi scariche. Inoltre la piastra isolante a contatto col paziente deve essere posta il più lontano possibile dalla scatola del pace-maker evitando che questa sia situata tra la piastra e il campo operatorio.
I defibrillatori
impiantabili devono essere disattivati prima dell'inizio dell'atto
chirurgico. L'impiego del bisturi elettrico, come pure la defibrillazione
esterna, può infatti danneggiare in modo permanente il dispositivo antiaritmico;
in aggiunta, la corrente generata dall'elettrobisturi può essere letta dal
dispositivo come "aritmia maligna" e attivare pertanto una
defibrillazione interna inopportuna e pericolosa (innesco di una aritmia
ventricolare maligna).
Pazienti sottoposti a trapianto cardiaco [42]. In aggiunta alle problematiche legate all'immunosoppressione (aumentata suscettibilità alle infezioni) e agli effetti collaterali della terapia (nefrotossicità da clclosporina, depressione corticosurrenalica da glicocorticoidi), il paziente sottoposto a trapianto cardiaco presenta problematiche peculiari poichè il cuore trapiantato è denervato. La denervazione cardiaca implica che:
1. mancano i riflessi barorecettoriali dall’arco aortico e dal seno carotideo;
2. il cuore risponde prontamente alle catecolamine di sintesi ma con più lentezza alle catecolamine endogene;
3. l’aumento della portata cardiaca avviene per aumento della gettata sistolica;
4. l’alleggerimento del piano di anestesia non causa tachicardia in via riflessa;
5. il paziente è molto sensibile all’ipovolemia e alle variazioni di postura;
6. la somministrazione di farmaci che agiscono sulla frequenza cardiaca tramite attivazione del sistema nervoso autonomo (l’atropina, in primo luogo) non modifica la frequenza stessa.
Pazienti con protesi valvolari meccaniche. Le problematiche peculiari in questi pazienti sono in relazione alla necessità di un’anticoagulazione cronica (vedi: Aspetti specifici sulla terapia con farmaci attivi sull'emostasi) e all’elevata suscettibilità alle infezioni della valvola protesica.
I portatori di protesi valvolari devono effettuare la profilassi antibiotica dell’endocardite infettiva in occasione di procedure diagnostiche e terapeutiche potenzialmente associate a batteriemia (incluse le procedure odontoiatriche!) e di fatti flogistici a possibile eziologia batterica (flogosi delle vie respiratorie, delle vie urinarie, escoriazioni cutanee) [43].
Anestesia
generale verso anestesia loco-regionale.
L'anestesia generale e loco-regionale, se correttamente applicate, non presentano differenze importanti in merito al rispetto della funzione cardiaca. La scelta di una particolare tecnica quindi deve essere effettuata in base al tipo di procedura chirurgica, alle caratteristiche fisiche e psicologiche del paziente, alla familiarità dell’anestesista con la tecnica prescelta, all'ambiente in cui avrà luogo il decorso postoperatorio (con speciale riferimento alla possibilità di trasferire il paziente in un ambiente intensivo).
Allo stato attuale delle conoscenze, anche per quanto attiene all’incidenza di complicazioni cardiovascolari perioperatorie, non pare esista differenza tra tecniche di anestesia generale e loco-regionale [44]. Vale la pena di ricordare a questo proposito il lavoro di Shah [2], che stima pari al 3% l'incidenza di infarto miocardico dopo interventi in anestesia loco-regionale ed identifica i pazienti diabetici ed i coronaropatici con ischemia silente come sottogruppi di pazienti a rischio di complicanze particolarmente elevato.
Monitoraggio
intraoperatorio
Le procedure chirurgiche di breve durata, eseguibili con anestesia locale, cioè buona parte di quelle in classe di rischio C, possono essere gestibili con una semplice MAC (monitored anesthesia care) e pertanto con ECG, pulsossimetria e pressione arteriosa non invasiva.
Per gli interventi in classe di rischio superiore (classi B e A), il monitoraggio di base deve prevedere la rilevazione in continuo dell'ECG con cavo a 5 derivazioni e possibilmente 2 derivazioni in lettura continua simultanea (preferibilmente D2 e V4 o V5), pulsossimetria, capnometria, rilevazione della temperatura nasofaringea e pressione arteriosa cruenta. La gestione della volemia non può prescindere dalla valutazione oraria, oltre che delle perdite chirurgiche, della diuresi. Per gli interventi di classe A e buona parte di quelli in classe B, è opportuna la incannulazione di un vaso centrale per la valutazione della pressione venosa centrale.
Tecniche
supplementari di monitoraggio (analisi del tratto ST, cateterismo destro,
ecografia transesofagea) devono essere messe in atto in casi selezionati.
Quanto all'analisi del tratto ST, è noto che esiste una correlazione positiva tra episodi ischemici preoperatori ed outcome [1]. L'attuale tecnologia di analisi computerizzata dell'ECG e del tratto ST permette di rilevare gli episodi ischemici con sensibilità e specificità elevate. L'analisi del tratto ST può essere consigliata nei pazienti con angina stabile a bassa soglia o con angina instabile.
Il cateterismo cardiaco destro mediante catetere di Swan-Ganz non garantisce una rilevazione accurata degli episodi di ischemia miocardica intraoperatori, come dimostrano i bassi valori di specificità e sensibilità sulle variazioni della pressione di incuneamento [45]. Tuttavia, il catetere di Swan-Ganz fornisce utili dati sulla volemia, sulla portata cardiaca e sulle resistenze vascolari. Il catetere di Swan-Ganz a fibre ottiche in aggiunta consente la misurazione in continuo della saturazione venosa mista di ossigeno (SvO2) che, una volta escluse variazioni importanti di SaO2 e di emoglobina, è indicativa di variazioni (nello stesso senso) della portata cardiaca.
L'impatto dell'impiego intraoperatorio del cateterismo cardiaco destro nella gestione dei pazienti è stato valutato dall'ASA nel 1993 [46]. Dagli studi esaminati non sono emerse evidenze forti per motivare l'impiego intraoperatorio del catetere di Swan-Ganz, il cui utilizzo è consigliabile solo nelle situazioni che prevedibilmente espongono il paziente ad elevato rischio di compromissione emodinamica.
Limitatamente alla gestione del paziente critico, l’opportunità del cateterismo cardiaco destro rappresenta un problema tuttora insoluto per la difficoltà a stabilire scientificamente l’impatto della procedura sulla sopravvivenza dei pazienti, essendo a questo fine necessario un campione di dimensioni considerevoli. Infatti, se si volesse evidenziare una riduzione della mortalità dello 0.2% nel gruppo trattato con cateterismo destro rispetto ad un gruppo di controllo con mortalità del 3%, sarebbe necessario reclutare 233.010 pazienti con catetere di Swan Ganz (intervallo di confidenza del 95% e potenza del test dell’80%) [49]. In aggiunta, in un recente studio di Connors et al. [47], è stato ipotizzato un effetto netto di aumento della mortalità nel gruppo di pazienti in cui il cateterismo destro veniva applicato, un fatto che ha spinto alcuni Autori [48] ad auspicarne un attento impiego.
In sintesi, il posizionamento intraoperatorio del catetere di Swan-Ganz è consigliabile negli interventi caratterizzati da elevato stress emodinamico e marcato spostamento di fluidi tra il compartimento centrale e i comparti tessutali. Esso è inoltre utile nei pazienti con depressa funzione contrattile, in cui la conoscenza del valore di pressione venosa centrale non è indicativa delle pressioni di riempimento nelle cavità sinistre e pertanto non può essere impiegata per guidare la terapia cardiovasoattiva. La scelta deve essere legata alla necessità di acquisire informazioni utili per la gestione ottimale in ogni singolo caso, valutando il rapporto costo-beneficio della scelta, senza dare eccessivo peso al rischio di complicanze, che in mani esperte è relativamente basso.
L'ecografia transesofagea (TEE) fornisce informazioni qualitative e quantitative di elevato valore diagnostico sulla volemia, sulla cinesi globale e segmentaria di entrambi i ventricoli e sull'apparato valvolare cardiaco.
Per quanto attiene specificamente alle variazioni della cinesi segmentaria in concomitanza di episodi ischemici, i riscontri ecocardiografici sono più numerosi e più precoci rispetto alle corrispondenti modificazioni elettrocardiografiche. Malgrado al momento attuale ci sia poca evidenza diretta che la diagnosi di ischemia miocardica mediante TEE migliori la prognosi, l'ASA nel suo documento del 1996 conclude che tale evidenza si può desumere indirettamente dagli studi che dimostrano come un precoce trattamento dell'ischemia e dell'infarto miocardico migliorino la sopravvivenza [50].
La TEE è una tecnica consigliabile in pazienti con stenosi aortica critica, con funzione di pompa depressa e con elevato rischio di ischemia miocardica, soprattutto nei casi in cui l'ECG ha un valore diagnostico limitato per presenza di ritmo da pace-maker o per blocco di branca sinistro.
Un'applicazione clinica estensiva dell'ecografia transesofagea è purtroppo spesso limitata dalla difficoltà a disporre in sala operatoria dell'apparecchiatura necessaria e di un operatore esperto. Un ulteriore limite della tecnica è rappresentato dal fatto che, per ovvie ragioni, la sonda viene inserita dopo l'induzione della narcosi e rimossa prima dell'estubazione del paziente, il che non consente di monitorizzare due fasi della narcosi caratterizzate da elevato stress emodinamico.
Gestione postoperatoria del cardiopatico nell'ambito della chirurgia non cardiaca
A fine intervento, la decisione in merito alla collocazione del paziente in recovery room, terapia intensiva o reparto di degenza dipende da una serie di parametri, tra cui sono particolarmente importanti le condizioni generali e la/e patologia/e di base del paziente, la procedura chirurgica effettuata, il decorso intraoperatorio, la logistica propria della struttura in cui avverrà il decorso postoperatorio e il livello di assistenza disponibile.
Indipendentemente dal luogo (ambiente intensivo, subintensivo o reparto di degenza) in cui il paziente trascorre il periodo postoperatorio, dal punto di vista logistico-organizzativo, non lontano dal posto letto deve essere presente un cardiomonitor con defibrillatore funzionante. Il letto, inoltre, deve essere provvisto di un tavolato rigido sotto il torace al fine di assicurare l'efficacia di un eventuale massaggio cardiaco esterno.
Il rischio di ischemia miocardica è maggiore nelle prime 48-72 h postoperatorie; pertanto le misure di monitoraggio dell'ischemia miocardica devono essere protratte almeno per questo periodo.
Il monitoraggio delle condizioni cliniche include, oltre che la sorveglianza del paziente, la rilevazione dei parametri vitali (frequenza cardiaca, pressione arteriosa, diuresi, saturazione arteriosa di ossigeno per via transcutanea).Tra i criteri di dimissibilità del paziente dalle unità di cure intermedie al reparto non si può omettere la normalità dello stato neurologico e dell'equilibrio acido-base, oltre che dei parametri emodinamici ed elettrocardiografici precedentemente citati.
Come detto, indipendentemente dalla cardiopatia di base, il paziente cardiopatico tollera male le situazioni di aumentato consumo di ossigeno.
Nel postoperatorio immediato tali situazioni sono fondamentalmente dovute al brivido e al dolore. Pertanto, un buon riscaldamento corporeo e una terapia analgesica adeguata costituiscono i presupposti per un decorso postoperatorio non complicato da problematiche di natura cardiaca.
Indipendentemente dall'adeguatezza della terapia analgesica, nel periodo postoperatorio l'organismo deve affrontare uno stato di stress dovuto in ogni caso ad un aumentato catabolismo e, talora, ad anemia, ipovolemia e ipertermia. Nel paziente cardiopatico, data la spesso limitata la possibilità di adeguare la portata cardiaca negli stati di stress, il verificarsi di queste situazioni cliniche comporta il concreto pericolo di una inadeguata perfusione tessutale. Una cura particolare va quindi posta nell'evitare gli squilibri volemici e nel trattare gli stati ipertermici [51].
Quanto alla relazione tra anemia e ischemia miocardica intra e postoperatoria, un recente lavoro di Hogue et al [52] ha dimostrato che l'incidenza di complicanze ischemiche è maggiore nei pazienti anziani con valori di ematocrito <28%, specialmente se coesiste tachicardia. Questa evidenza motiva il consiglio di considerare come soglia per la trasfusione nel paziente critico un valore di emoglobina di 10 g/dl [53].
In molti casi l’ischemia postoperatoria non è dovuta a turbe emodinamiche ma ad alterazioni emoreologiche mediate dalla reazione allo stress, il cui corrispettivo clinico è un sindrome infiammatoria sistemica con tendenza alla trombofilia. Per questo motivo, soprattutto nei pazienti cardiopatici, è opportuno riprendere la terapia anticoagulante e antiaggregante piastrinica non appena si possa ragionevolmente escludere o considerare ridotto il rischio di complicanze emorragiche di natura chirurgica.
1. Slogoff S, Keats AS. Does perioperative myocardial ischemia lead to
postoperative myocardial infarction? Anesthesiology 1985; 62:107-114.
2. Shah KB, Kleinman BS, Rao T et al. Angina and other risk factors in
patients with cardiac diseases undergoing noncardiac operations.
Anesth.Analg1990; 70:240-247.
3. Steen PA, Tinker JH, Tarhan S. Myocardial reinfarction after anaesthesia
and surgery. JAMA 1978; 239:2566-2570.
4. American College of Physicians. Guidelines for assessing and managing the
perioperative risk from coronary artery disease associated with major noncardiac
surgery. Ann Int Med 1997; 127:309-312.
5. Acharya DU, Shekhar YC, Aggarwal A et al. Lack of pain during myocardial
infartion in diabetics - Is autonomic dysfunction responsible? Am J Cardiol
1991; 68:793-796
6. Goldman L, Caldera DL, Nussbaum SR et al. Multifactorial index of cardiac
risk in noncardiac surgical procedures. N Engl J Med 1977; 297:845-850.
7. American College of Cardiology/American Heart Association Task Force
Report. Guidelines for perioperative cardiovascular evaluation for noncardiac
surgery Circulation 1996; 93:1278-1317.
8. Guidelines for perioperative cardiovascular evaluation for noncardiac
surgery. Report of the American College of Cardiology/ American Heart
Association Task Force on practical guidelines (commmittee on perioperative
cardiovascular evaluation for noncardiac surgery). J Am Coll Cardiol 1996;
27:910-948.
9. Palda VA, Detsky AS. Perioperative assessment and management of risk from
coronary artery disease. Ann Int Med 1997;127:313-328.
10. Detsky AS, Abrams HB, McLaughlin JR et al. Predicting cardiac
complications in patients undergoing non-cardiac surgery. J Gen Int Med 1986;
1:211-219.
11. Eagle KA, Coley CM, Newell JB et al. Combining clinical and thallium data
optimizes preoperative assessment of cardiac risk before major vascular surgery.
Ann Int Med 1989;110:859-866.
12. Vanzetto G, Machecourt J, Blendea D et al. Additive value of thallium
single-photon emission computed tomography myocardial imaging for prediction of
perioperative events in clinically selected high cardiac risk patients having
abdominal aortic surgery. Am J Cardiol 1996; 77:143-148.
13. Baron JF, Mundler O, Bertrand M et al. Dipyridamole-thallium scintigraphy
and gated radionuclide angiography to assess cardiac risk before abdominal
aortic surgery. N Engl J Med 1994; 330:663-669.
14. McCann RL, Wolfe WG. Resection of abdominal aortic aneurysm in patients
with low ejection fractions. J Vasc Surg 1989; 10:240-244.
15. Kaaja R, Sell H, Erkola O, Harjula A. Predictive value of manual
ECG-monitored exercise test before abdominal aortic or peripheral vascular
surgery. Angiology 1993; 44:11-15.
16. Carliner NH, Fisher ML, Plotnick GD et al. Routine preoperative exercise
testing in patients undergoing major noncardiac surgery. Am J Cardiol 1985;
56:51-58.
17. Poldermans D, Arnese M, Fioretti P et al. Improved cardiac risk
stratification in major vascular surgery with dobutamine-atropine stress
echocardiography. J Am Coll Cardiol 1995; 26:648-653.
18. Lane RT, Sawada SG, Segar DS et al. Dobutamine stress echocardiography
for assessment of cardiac risk before noncardiac surgery. Am J Cardiol 1991;
68:976-977.
19. Mangano DT, Browner WS, Hollenberg M et al. Association of perioperative
myocardial ischemia with cardiac morbidity and mortality in men undergoing
noncardiac surgery. The Study of Perioperative Ischemia Research Group. N Engl J
Med 1990; 323:1781-1788.
20. Mason JJ, Owens DK, Harris RA et al. The role of coronary angiography and
coronary revascularization before noncardiac vascular surgery. JAMA 1995;
273:1919-1925.
21. Fleisher LA, Skolnick ED, Holroyd KJ, Lehmann HP. Coronary artery
revascularization before abdominal aortic aneurysm surgery: a decision analytic
approach. Anesth Analg 1994; 79:661-669.
22. Gottlieb A, Banoub M, Sprung J et al. Perioperative cardiovascular
morbidity in patients with coronary artery disease undergoing vascular surgery
after percutaneuos transluminal coronary angioplasty. J Cardiothorac Vasc Surg
1998; 12:501-506.
23. Guidelines and indications for coronary artery bypass surgery. A report
of the American College of Cardiology/American Heart Association Task Force on
Assessment of Diagnostic and Therapeutic Cardiovascular Procedures (Subcommittee
on Coronary Artery Bypass Graft Surgery). J Am Coll Cardiol 1991; 17:543-589.
24. Smith MS, Muir H, Hall R. Perioperative management of drug therapy.
Clinical Considerations. Drugs 1996; 51:238-259.
25. Sonksen J, Gray R, Hickman PH. Safer non-cardiac surgery for patients
with coronary artery disease. Br Med J 1998; 317:1400-1401
26. Mangano DT, Layung EL, Wallace A, Tareo I. Effects of atenolol on
mortality and cardiovascular morbidity after noncardiac surgery. The Multicenter
Study of Perioperative Ischemia Research Group. N Engl J Med 1996;
335:1713-1720.
27. Hayashi Y, Maze M. Alpha2 adrenoceptor agonists and anesthesia. Br J
Anesth, 1993; 71:108-118.
28. Coriat P, Richer C Douraki T et al. Influence of chronic
angiotensin-converting enzyme inhibition on anesthetic induction. Anesthesiology
1994; 81: 299-307
29. Mason JW. Amiodarone. N Engl J Med 1987; 316:455-466.
30. Guslandi M. Gastric toxicity of antiplatelet therapy withlow-dose
aspirin. Drugs 1997; 53:1-5.
31. Tabuchi Y, Nosaka S, Amakata Y et al. Perioperative management for
nephrectomy in a long-term hemodialysis patient with anticoagulants for coronary
stent. Masui 1998; 47:720-725.
32. Levy G. Anomalies préopératoires de l'hemostase. Enc Med Chir, Anesth
Réanim IV:36-657-L-10,1996.
33. Horlocker TT, Wedel DJ, Schroederr DR et al. Preoperative antiplatelet
therapy does not increase the risk of spinal haematoma associated with regional
anesthesia. Anesth Analg 1995; 80:303-309.
34. Kearon C, Hirsh J. Management of anticoagulation before and after
elective surgery. N Engl J Med 1997; 336:1506-1511.
35. Fifth ACCP consensus conference on antithrombotic therapy. Chest 1998,
114 (Supplemento).
36. Tavel ME, Stein PD. Management of anticoagulants in a patient requiring
major surgery. Chest 1998; 114:1756-1758.
37. Hirsh J. Reversal of the anticoagulant effects of warfarin by vitamin K1.
Chest 1998; 114:1505-1507.
38. Wentzien TH, O'Reilly RA, Kearns PJ. Prospective evaluation of
anticoagulant reversal with oral vitamin K1 while continuing warfarin therapy
unchanged. Chest 1998; 114: 1546- 1550.
39. Lichtor JL, Zacny JP. Psychological preparation and preoperative
medication. In: Anesthesia. Ed: RD Miller. Churchill Livingstone, 1994;
pg:1015-1043.
40. Dajani AS, Taubert KA, Wilson W et al. Prevention of bacterial
endocarditis. Recomandations by the American Heart Association. Circulation
1997; 96:358-366.
41. Metha Y, Swaminathan M, Juneja R et al. Noncardiac surgery and pacemaker
cardioverter defibrillator management. J Cardiothorac Vasc Anesth 1998;
12:221-224.
42. Steib A, Freys G, Otteni JC. Anesthésie pour chirurgie non spécificque
chez le patient transplanté. Ann Fr Anesth Réanim 1993; 12:27-37.
43. Durack DT, Phil D. Prevention of infective endocarditis. N Engl J Med
1995; 332:38-44.
44. Mangano DT. Perioperatice cardiac morbidity. Anesthesiology 1990;
72:153-184.
45. van Daele MERM, Sutherland GR, Mitchell MM et al. Do changes in pulmonary
capillary wegde pressure adequately reflect myocardial ischemia during
anesthesia? Circulation 1990; 81:865-871.
46. Practice guidelines for pulmonary artery catetherization. A report by the
American Society of Anesthesiologists Task Force on Pulmonary Artery
Catetherization. Anesthesiology 1993; 78:380-394.
47. Connors AF, Speroff T, Dawson NV, Thomas C, Harrell FE, Wagner D,
Desbiens N, Goldman L, Wu AW, Califf RM, Fulkerson WJ, Vidaillet H, Broste S,
Bellamy P, Lynn J, Knaus WA. The effectiveness of right heart catheterization in
the initial care of critically ill patients. JAMA 1996; 276:889-897.
48. Dalen JE, Bone RC. Is the time to pull the pulmonary artery
catheter? JAMA 1996; 276:916-918.
49. Spackman TN. A theoretical evaluation of cost-effectiveness of
pulmonary artery catheters in patients undergoing coronary artery surgery. J
Cardiothorac Vasc Anesth 1994; 8:570-576.
50. Practice guidelines for perioperative transesophageal echocardiography. A
report by the American Society of Anesthesiologists and Society of
Cardiovascular Anesthesiologists Task Force on Transesophageal Echocardiography.
Anesthesiology 1996; 84:986-1006.
51. Le Réveille R, Dorol J, Lentz T. Hyperthermie chez l'adulte. Enc
Med Chir, Urgences II:24-116-A-15,1999.
52. Hogue CWJr, Goodnough LT, Monk TG. Perioperative myocardial ischemic
episodes are related to hematocrit level in patients undergoing radical
prostatectomy. Transfusion 1998; 38:924-931.
53. Goodnough LT, Brecher ME, Kanter MH et al. Transfusion Medicine. Blood
Transfusion. N Engl J Med 1999; 340:438-447.
54. Cummins D, Hill E. Heparin-induced thrombocytopenia. Sem Cardiothorac
Vasc Anesth 1997; 1:349-365.
55. Sirieix D, Lamonerie-Alvarez L, Olivier P et al. Evaluation du risque cardiovasculaire périopératoire en chirurgie non cardiaque. Ann Fr Anesth Réanim 1998; 17:1225-1231