

ISSN 1080-3521
EDUCATIONAL SYNOPSES IN ANESTHESIOLOGY
and
CRITICAL CARE MEDICINE - Italia -
Il giornale Italiano online di anestesia Vol 5 No 5 Maggio 2000
Vincenzo Lanza, MDServizio di Anestesia e RianimazioneOspedale Buccheri La Ferla Fatebenefratelli Palermo, ItalyE-mail: lanza@mbox.unipa.it |
Keith J Ruskin, MDDepartment of Anesthesiology Yale University School of Medicine333 Cedar Street, New Haven, CT 06520 USAE-mail: ruskin@gasnet.med.yale.edu |
Copyright (C) 1997 Educational Synopses in Anesthesiology and Critical Care Medicine. All rights reserved. Questo rivista on-line può essere copiata e distribuita liberamente curando che venga distribuita integralmente, e che siano riportati fedelmente tutti gli autori ed il comitato editoriale. Informazioni sulla rivista sono riportate alla fine |
|
In questo numero:
1 Ventilazione monopolmonare in chirurgia
toracica
2 Pancreatite acuta: revisione clinica
_______________________________________________________
Ventilazione monopolmonare in chirurgia toracica
_______________________________________________________
Girolamo Tamburello, dirigente II liv.
Unità Operativa di Anestesia e Rianimazione - Azienda Ospedaliera V.Cervello -
Palermo
girotamb@tin.it
La ventilazione monopolmonare (OLV = One Lung
Ventilation) è applicata comunemente in chirurgia toracica, ma può essere essenziale in situazioni di emergenza ed essere utile in patologia polmonare unilaterale, dove lo scopo è quello di ridurre il carico ventilatorio meccanico sul polmone malato e i danni che ne conseguono.
Le indicazioni della OLV possono essere assolute o relative.
| -sanguinamento massivo in cui l’isolamento del polmone dal quale proviene l’emorragia, può essere determinante per salvare la vita di un paziente. -sepsi e pus, per proteggere il polmone sano dalla contaminazione. -fistole broncopleuriche o broncocutanee quando, in ventilazione meccanica la resistenza al flusso è tanto bassa da comportare una grossa perdita aerea e compromettere la ventilazione efficace. -bolle gassose unilaterali.In questo caso l’isolamento del polmone è d’obbligo perché si possono rompere sotto ventilazione meccanica. -lavaggio alveolare per proteinosi alveolare o fibrosi cistica, dove serve a proteggere il polmone controlaterale dall’essere annegato. -Infine, sulla scia dell’entusiasmo per la chirurgia mininvasiva, sempre più frequenti sono gli interventi in videotoracoscopia e in questo caso la OLV è necessaria per offrire al chirurgo visibilità e ampiezza del campo operatorio. |
| -Pneumectomia -Lobectomia e tra queste soprattutto la superiore, meno la media e l’inferiore -L’esofagectomia -La riparazione di aneurisma dell’aorta toracica è pure un’indicazione relativa. |
In conclusione le applicazioni più frequenti della OLV sono indicazioni relative e nei fatti la scelta operativa dipende certamente dall’abilità e dall’esperienza degli anestesisti ma soprattutto dalle preferenze del Chirurgo Toracico.
Metodi di separazione del polmone:
- In passato venivano adoperati bloccatori bronchiali e tubi endobronchiali a lume singolo, ma questi sistemi sono stati abbandonati per le difficoltà tecniche e per l’impossibilità di effettuare la rimozione delle secrezioni dal polmone del lato bloccato.
- Attualmente sono più frequentemente adoperati tubi a doppio lume senza sperone per evitare attorcigliamenti ed eventuali lacerazioni tracheali e bronchiali. Questi tubi sono quelli di Robertshaw i quali posseggono una conformazione prefissata che diversifica le versioni dx e sn; il tubo a doppio lume lato dx ha una apertura per la ventilazione del lobo polmonare superiore dx ma la maggior parte degli autori è restia ad adoperarlo per evitare potenziali ostacoli. Inizialmente in gomma rossa, vengono oggi prodotti dalla maggior parte delle case produttrici in PVC, di tipo disposable e con cuffia di colore bleu per una migliore identificazione alla broncofibroscopia.
Le misure disponibili vanno da 35 a 41 FR. La 37 è quella adoperata nella maggior parte delle donne adulte mentre la 39 FR nella maggior parte degli uomini adulti.
- In ultimo un riferimento particolare merita il tubo endotracheale combinato con bloccatore (tubo Univent) per le sue doti di originalità e per la semplicità di esecuzione tecnica.
Posizionamento del tubo a doppio lume:
Prima andrebbe gonfiata la cuffia tracheale, i rumori respiratori vanno verificati subito dopo, in ambedue i campi polmonari; la cuffia bronchiale va gonfiata gradualmente, per evitare che eccessive pressioni possano danneggiare la mucosa bronchiale, fino a bloccare la perdita di aria verso il lume tracheale; in genere non occorrono più di 2 ml di aria.
I rumori respiratori vanno nuovamente ascoltati bilateralmente per escludere che la cuffia bronchiale troppo gonfia non si sia erniata al di la della carena e comprometta la ventilazione del polmone controlaterale.
Un punto importante e fondamentale è quello di verificare che l’estremità bronchiale sia perfettamente collocata nel bronco designato, per fare ciò si clampa prima il lume tracheale a livello del collettore, ventilando attraverso il lume bronchiale, si guarda e si ascolta: l’ispezione rivelerà l’assenza di movimento e l’ascoltazione l’assenza di murmure dal lato clampato. La stessa operazione è fatta successivamente clampando il lume bronchiale e ventilando attraverso quello tracheale.
| posizionamento del tubo a doppio lume |
|
Quando si usa un tubo a doppio lume lato dx bisogna assicurare una appropriata ventilazione del campo del lobo polmonare sup. dx con adeguata ascoltazione o più accuratamente attraverso l’esame fibrobroncoscopico.
Quando si usa un tubo a doppio lume lato sn non si può escludere il rischio che l’estremità bronchiale, avanzata troppo profondamente nel lume del bronco principale sn, possa avere ostruito il lume del bronco lobare sup. sn.
Quando le pressioni di insufflazione, durante ventilazione dei 2 polmoni, sono 20 cm di H2O, a parità di volume corrente, non dovrebbero superare i 40 cm di
H2O, durante ventilazione di un solo polmone e i valori spirometrici dovrebbero corrispondere a quelli precedenti la OLV.
E’ dimostrato che tubi a doppio lume perfettamente posizionati con adeguato controllo ispettivo e ascoltatorio, mostravano successivamente al controllo fibrobroncoscopico un’incidenza di malposizionamento del 20-48%.
Controllo fibrobroncoscopico
fig.1 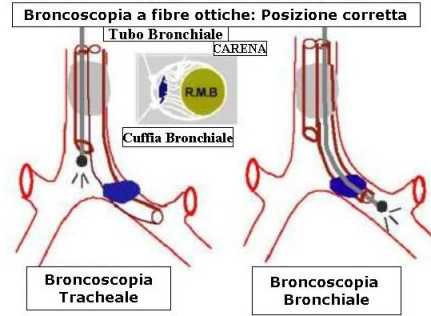
La Fig. 1 mostra il tubo a doppio lume lato sn in situ, dove la broncoscopia, attraverso il lume tracheale mette facilmente in evidenza la carena e soltanto l’estremità prossimale della cuffia bronchiale subito al di la di questa.L’erniazione della cuffia bronchiale sopra la carena può ostruire il bronco principale opposto e deve essere corretta.La cuffia bronchiale dei tubi in PVC è facilmente riconoscibile, mentre quella dei tubi rossi non disposable, gialla, era di difficile riconoscimento. La broncoscopia attraverso il lume bronchiale deve identificare l’orificio del bronco lobare sup. sn pervio.
fig.2 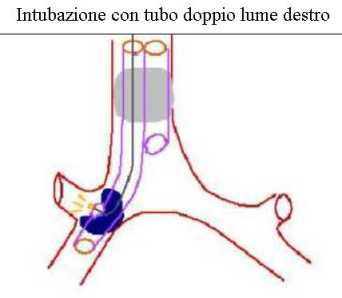
La Fig.2 mostra il tubo a doppio lume lato dx, dove la broncoscopia attraverso il lume tracheale visualizza la carena e anche qui solo l’estremità della cuffia bronchiale, ma il punto più difficile è l’esame broncoscopico attraverso il lume bronchiale per identificare, quando il broncoscopio passa attraverso l’apertura per la ventilazione del lobo polmonare sup. dx, l’orificio del bronco lobare sup.dx Questa procedura è molto complicata e richiede l’intervento di un broncoscopista esperto.
Sono disponibili diverse misure di fibrobroncoscopio, quelle più comuni sono la 5,6 la 4,9 la 3,9 mm di diametro esterno. La 3,9 può passare attraverso un tubo 37FR ma è troppo grande per un 35FR.
Problemi associati al posizionamento dei tubi a doppio lume
- Nonostante la mancanza dello sperone sono possibili lacerazioni tracheali e bronchiali dovute alla conformazione preformata, ma soprattutto alla mancata estrazione del mandrino al momento della rotazione del tubo.
- E’ possibile un errato posizionamento: il tubo a doppio lume lato sn può erroneamente essere introdotto a dx, in questo caso la ventilazione del campo polmonare sup. dx sarà difettosa e,
poichè il tubo può non essere penetrato sufficientemente in profondità nel bronco principale dx, il murmure sarà presente su ambedue i campi polmonari quando si ventila attraverso il lume bronchiale ma sarà assente se la
ventilazione avviene attraverso quello tracheale.
- Il tubo a doppio lume lato dx può ostruire l’orificio del bronco lobare sup. dx, questa eventualità è frequente perché la distanza tra la carena e l’orificio del bronco lobare sup. dx è molto corta tra 1,5 e 2cm con un margine di sicurezza tra 1 e 8mm.
- Il tubo a doppio lume lato sn può ostruire, anche se la distanza tra carena e bronco lobare sup sn. è tra 5 e 5,5 cm, l’orificio del bronco lobare sup. sn; è necessario pertanto ritirare il tubo di 1 cm per ripristinare la ventilazione del campo polmonare sup. sn.
- la cuffia troppo gonfia per lungo tempo può danneggiare la mucosa bronchiale, quando possibile (indicazioni relative) la cuffia andrebbe sgonfiata se le fasi dell’intervento lo consentono.
Abbiamo in precedenza accennato al tubo Univent:
Questo tubo possiede nel contesto della sua parete, anteriormente, un canale che dà passaggio al dispositivo di blocco bronchiale.
Il dispositivo bloccante ha all’estremità un palloncino gonfiabile e all’interno un canale di 2mm di diametro che può servire per aspirare o per applicare la CPAP.
Questo tubo è introdotto come un tubo endotracheale comune. Quando si deve procedere all’inserimento del dispositivo bloccante, si ruota la testa del paziente e il tubo dal lato da bloccare e sotto guida fibrobroncoscopica lo si fa scorrere distalmente verso il bronco principale designato.Quando è ben collocato nel bronco, si gonfia il palloncino con 6-7ml di aria. In alternativa si può intubare direttamente con lo stesso tubo il bronco principale e succesivamente ,mentre il dispositivo bloccante viene mantenuto in situ, il tubo viene ritirato in posizione tracheale.
fig.3 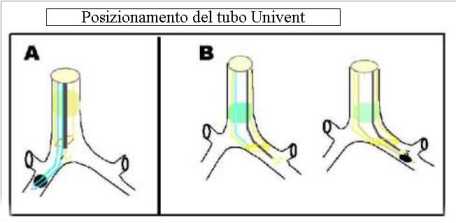 |
| Vantaggi: - lume singolo - possibilità di aspirazione da lato non ventilato - possibilità di applicazione di CPAP sul polmone non ventilato - possibilità di continuare la ventilazione post-operatoria con lo stesso tubo. |
| Svantaggi: - più difficoltosa la tenuta e più frequente la dislocazione con le manovre chirurgiche. - il piccolo diametro interno del dispositivo bloccante può rendere difficile l’aspirazione. - tempo di collasso polmonare più lungo che comunque lo stesso chirurgo può accelerare con una manovra manuale. |
| Indicazioni: Nonostante gli svantaggi peraltro relativi, questo tubo è certamente un presidio prezioso, in particolare: -quando è impossibile mettere un tubo a doppio lume. -In prima intenzione: stomaco pieno, intubazione prevista difficile, paziente ipossiemico, quando il calibro tracheale e bronchiale sono ridotti. |
lll Approccio clinico alla ventilazione di un solo polmone.
Dopo lo spostamento del paziente in decubito laterale è indispensabile ricontrollare il posizionamento del tubo perchè è frequente la dislocazione dovuta al cambiamento di posizione.
La ventilazione di ambedue i polmoni andrebbe mantenuta il più a lungo possibile.
Al momento della esclusione una Fi O2 di 1 è sufficiente a garantire una adeguata ossigenazione. In presenza di una normale vasocostrizione ipossica la PaO2 sarà tra 150 e 210 mm di Hg.
La causa di tale desaturazione arteriosa è lo shunt del polmone non dipendente. Il polmone non dipendente non ventilato sarà comunque ancora perfuso
Il grado di shunt dipende sia dalla posizione che favorisce la perfusione del polmone dipendente a spese del polmone non dipendente ma soprattutto dal grado di vasocostrizione ipossica che inizia ad una PAO2 di 100 mm di Hg e raggiunge la massima riduzione di flusso pari al 50% a 40 mm di PAO2.
Lo shunt che ne risulta varia mediamente nella pratica clinica tra il 20 e il 40%.
Questo meccanismo non è sempre conservato nella sua piena efficienza e patologie polmonari o interventi
farmacologici lo possono annullare pressocchè completamente.
In pratica vengono utilizzate FiO2 tra 0,5 e 1.
FiO2 elevate possono dare teoricamente danni tossici polmonari ma è poco probabile che ciò avvenga nel breve tempo di un intervento chirurgico, mentre è possibile che alte FiO2 possano determinare atelettasie da riassorbimento ed incrementare lo shunt.
In questo caso sembra promettente l’utilizzo del NO che oltre a ridurre lo shunt permette una riduzione della dose di potenti anestetici cardiodepressivi con conseguenti vantaggi nei pazienti ad alto rischio cardiovascolare e la cui somministrazione è da considerare abbastanza sicura grazie ad un semplice controllo pulsossimetrico.
Il volume corrente consigliato varia da 10 a 12ml/Kg e la frequenza respiratoria deve essere tale da mantenere una PaCO2 di 35 (+/-3) mm di Hg, valutabile con facilità e sufficiente attendibilità attraverso la end-tidal CO2.
Volumi correnti più piccoli possono determinare microatelettasie e shunt nel polmone dipendente, volumi correnti più grandi possono deviare il flusso ematico verso il polmone non dipendente e peggiorare lo shunt.
Dall’inizio dell’esclusione del polmone e per circa 45 minuti la saturazione può continuare a diminuire rendendo indispensabile un controllo regolare dell’emogasanalisi e pulsossimetrico continuo.
lll
Tecniche per migliorare l’ossigenazione
Esistono diverse possibilità per migliorare l’ossigenszione ma la tecnica sicuramente più efficace è rappresentata dall’applicazione di CPAP al polmone non dipendente.
La sua azione sull’ossigenazione non è dovuta all’effetto pressione con deviazione di flusso al polmone dipendente, ma ad un effetto distensivo alveolare nel polmone non dipendente e alla possibilità di scambio gassoso in questi alveoli, infatti una CPAP della stessa entità applicata con N anzicchè con O2 non sortisce alcun effetto sulla ossigenazione.
La maggior parte degli studi più recenti conferma il sorprendente aumento della PaO2 dovuto all’applicazione della CPAP10.
E’ sufficiente una sorgente di O2 con una erogazione di 5 litri/min., un tubo di connessione e una valvola di pressione regolabile generalmente da 0 a 10cm di H2O. E’ opportuno che l’applicazione della CPAP inizi con l’erogazione al polmone non dipendente di un volume pari al tidal.
Un’altra possibilità per migliorare l’ossigenazione consiste nell’applicazione di PEEP10 (10cm di H20) al polmone dipendente,
ma si raccomanda, di applicare sempre questa PEEP associata alla CPAP al polmone non dipendente; la PEEP da sola applicata al polmone dipendente non migliora l’ossigenazione, probabilmente perché l’effetto benefico dovuto alla distensione e al reclutamento di alveoli atelettasici è controbilanciato dall’effetto deviazione di flusso verso il polmone non dipendente.
In conclusione il metodo preferito di menagement dell’ipossiemia durante OLV consiste nell’applicazione di CPAP al polmone non dipendente, associato alla ricerca di una ottimale combinazione di PEEP e di CPAP (tra 5 e 10 cm di
H2O).
In casi estremi nonostante le misure adottate la PaO2 continua a diminuire, una riventilazione intermittente del polmone non dipendente dovrà, allora, essere prevista con la collaborazione del chirurgo, inoltre se l’intervento programmato è una pneumectomia e la fase dell’intervento lo consente potrà essere eseguita in anticipo la legatura dell’arteria polmonare che eliminerà definitivamente la causa dello shunt.
Naturalmente in qualunque momento, qualora le condizioni del paziente dovessero diventare critiche con tachicardia e ipotensione, la ventilazione del polmone non dipendente dovrà essere ripresa fino a quando non saranno ristabilite condizioni di stabilità emodinamica.
In ultima analisi va anche ricordato che le indicazioni alla OLV sono frequentemente indicazioni soltanto relative.
In ogni caso un ulteriore controllo fibroscopico dovrà essere attuato sia per verificare un'adeguata ventilazione del lobo polmonare sup.dx che,
qualora si usa un tubo a doppio lume lato sn per toracotomia dx, per escludere che l’estremità bronchiale non ostruisca l’orificio del bronco lobare sup.sn. In questo caso ritirare il tubo di 1 cm ristabilisce condizioni di perfetta ventilazione ed ossigenazione.
Queste ultime eventualità sono favorite anche dalle manovre chirurgiche (palpazione, trazioni, occlusioni).Pertanto
necessita una stretta sorveglianza delle pressioni di insufflazione, dei valori spirometrici e del capnogramma per rivelare e riconoscere tempestivamente una situazione ostruttiva o un’alterazione degli scambi gassosi conseguente al malposizionamento del DLT.
lll
Ossido nitrico e ventilazione di un solo polmone
L’ossido nitrico è prodotto dalle cellule endoteliali a partire dalla L-arginina attraverso la via metabolica che richiede l’intervento della NO-sintetasi e diffonde sulla muscolatura liscia vascolare per dare rilasciamento e vasodilatazione previa attivazione della guanidil-ciclasi e la sintesi di 3,5GMPciclico.
Gli effetti clinici di nitroprussiato e nitroglicerina sono mediati dal rilasciamento intracellulare di NO.
L’NO ha anche azione su altre funzioni fisiologiche quali aggregazione piastrinica, neurotrasmissione e attività antitumorale e antimicrobica.
L’NO inalato in concentrazione da 5 a 80 ppm riduce le resistenze vascolari polmonari.
La sua azione è limitata al circolo polmonare e non interessa la circolazione sistemica, poiché dopo inalazione è assorbito e inattivato in circolo ad opera dell’emoglobina, infatti la sua emivita è di appena 110-130 ms.
Inoltre la sua azione si limita soltanto agli alveoli ventilati migliorando il rapporto V/Q.
Frostell ed altri hanno descritto gli effetti dell’inalazione di NO durante ipossia in volontari umani costatando che il NO faceva regredire selettivamente la vasocostrizione ipossica senza procurare vasodilatazione sistemica.
La maggiore applicazione clinica dell’NO riguarda le malattie cardiache congenite associate a ipertensione polmonare e grosso shunt sn-dx e le ipertensioni polmonari in genere.
| Ossido Nitrico e Ventilazione monopolmonare |
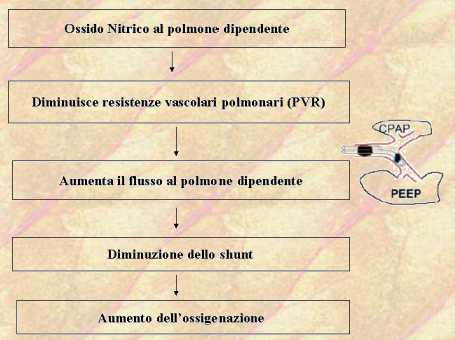 |
Si può dedurre il concetto che il NO possa modulare il grado di perfusione polmonare in aree selettive del polmone e, in particolare nella ventilazione di un solo polmone per toracotomia, la somministrazione di NO procurando vasodilatazione in questo polmone aumenterebbe gli effetti della vasocostrizione ipossica nel polmone non dipendente con aumento del flusso al polmone dipendente, riduzione dello shunt e miglioramento dell’ossigenazione arteriosa.
Studi preliminari durante ventilazione monopolmonare presentano risultati apparentemente contrastanti.
Booth e Al.somministrando NO a 40 ppm a 9 pazienti durante OLV riportano un miglioramento dell’ossigenazione in confronto a un gruppo di 6 pazienti di controllo, mentre Wilson e Al. in 6 pazienti nelle stesse condizioni di somministrazione (40 ppm) non confermano i risultati precedentemente riportati.
In questi ultimi pazienti con PVR normali Qs/Qt non ha subito alcun cambiamento.
Si può concludere che i benefici effetti del NO sono limitati in assenza di ipossiemia e di vasocostrizione polmonare. Pertanto sono i pazienti con ipossiemia ed elevata pressione polmonare che beneficeranno maggiormente, durante OLV, dell’applicazione del NO.
Il concetto di maggiore interesse, per una adeguata ossigenazione durante OLV, rimane la capacità a modulare la circolazione polmonare.
L’almitrine bimesylate un agonista dei chemiorecettori periferici, a basse dosi aumenta la vasocostrizione polmonare ipossica.
L’NO inalato e l’almitrine endovena sono stati combinati con effetti additivi sugli scambi gassosi.
L’utilizzo di questa combinazione, durante OLV, ha potenziato al massimo la vasocostrizione ipossica al polmone non dipendente mentre la vasodilatazione al polmone dipendente ha praticamente eliminato lo shunt transpolmonare (fig6).
Questa teoria è stata sottoposta a verifica da Moutafis e al.in 20 pazienti sottoposti a intervento in videotoracoscopia per resezione polmonare. Il gruppo di pazienti che riceveva la combinazione almitrine ed NO non aveva alcun decremento della PaO2 durante OLV.
Questo è importante in tutti i pazienti che hanno una riserva respiratoria minima e che non riescono a mantenere una sufficiente ossigenazione durante OLV.
Infine, sarebbe di grande utilità negli interventi in videotoracoscopia dove l’applicazione della CPAP al polmone non dipendente interferisce con l’abilità del chirurgo ad eseguire le manovre chirurgiche.
Bibliografia
1) E. Cohen, MD - New Trends in Thoracic
Anesthesia - ASA Refresher Course 1999
2) Campo JH et al.: Is there a better right-sided tube for one-lung ventilation?
A comparison of the right-sided double-lumen tube with the single lumen tube
with right-sided enclose bronchial blocker. Anesth Analg 696-700, 1998
3) Allen MS : Video-assisted Thoracoscopic surgical procedures: TheMayo
experience. Mayo Clin Proc 71:351, 1996
4) Freden F et al.: Nitric oxide modulation of pulmonary blood flow distribution
in lobar hypoxemia. Anesthesiology 82:1216-25,1995
5) Frostell C et al.: Inhaled nitric oxide: a selective pulmonary vasodilator
reversing hypoxic pulmonary vasoconstriction. Circulation 83:2039-47 1991
6) Booth J et al.: Effect of unilateral inhaled NO during selective ventilation
in anesthetized human. Anesthesiology 81:A1457,1994
7) Nakanishi S et al.: Almitrine enhances in low dose the reactivity of
pulmonary vessels to hypoxia. Respir Phisiol 74(2):139-50 1998