

ISSN 1080-3521
EDUCATIONAL SYNOPSES IN ANESTHESIOLOGY
and
CRITICAL CARE MEDICINE - Italia -
Il giornale Italiano online di anestesia Vol 7 n° 03 Marzo 2002
Vincenzo Lanza, MDServizio di Anestesia e RianimazioneOspedale Buccheri La Ferla Fatebenefratelli Palermo, ItalyE-mail: lanza@mbox.unipa.it |
Keith J Ruskin, MDDepartment of Anesthesiology Yale University School of Medicine333 Cedar Street, New Haven, CT 06520 USAE-mail: ruskin@gasnet.med.yale.edu |
Copyright (C) 1997 Educational Synopses in Anesthesiology and Critical Care Medicine. All rights reserved. Questo rivista on-line può essere copiata e distribuita liberamente curando che venga distribuita integralmente, e che siano riportati fedelmente tutti gli autori ed il comitato editoriale. Informazioni sulla rivista sono riportate alla fine |
|
In questo numero:
ATTI CONGRESSUALI ONLINE IX ESRA - ITALIAN CHAPTER CONGRESS 2002
1 - Schemi terapeutici in sicurezza: Oppioidi. - G. Savoia2 - Schemi terapeutici in sicurezza: Adiuvanti. - P. De Negri
3 - Regional anesthesia in Pain-free Hospital / ALR nell'ospedale senza dolore - A. Paolicchi
4 - Regional anaesthesia in Pain-free Hospital / In Pediatria. - A. Messeri
______________________________________________________
ATTI CONGRESSUALI ONLINE IX
ESRA - ITALIAN CHAPTER CONGRESS
La redazione di Esia-Italia è lieta di
presentare online gli atti del IX Congresso Nazionale ESRA (European Society of
Regional Anaesthesia) - Italian Chapter, tenutosi nel Novembre 2002 a Torino. I
presidenti, il comitato organizzatore e il comitato scientifico hanno promosso
questa iniziativa della pubblicazione dei lavori congressuali sul web,
attraverso ESIA. Infatti da una parte essa si inscrive tra gli scopi di
costituzione del gruppo ESRA, teso alla divulgazione delle conoscenze
sull'anestesia loco-regionale e alla sua sempre più ampia applicazione nei
diversi settori clinici, sottolineando i concetti di "Sicurezza e
Outcome" che hanno permeato l'intera attività congressuale, dall'altra si
incontra con le finalità di formazione scientifica e tecnica di ESIA-ITALIA,
che sfrutta le potenzialità di diffusione e l'immediatezza di approccio,
proprie di Internet.
Pertanto Esia-Italia dedica alcuni suoi numeri alla pubblicazione dei lavori
congressuali e delle comunicazioni migliori, riconosciute dal comitato ESRA. In
ogni caso la redazione di Esia-Italia non si riterrà responsabile di errori o
di omissioni ravvisabili nei testi prodotti nè dell'eventuale impropria
utilizzazione delle tecniche descritte.
_______________________________________________________
ESRA 2002 Italian Chapter - Relazioni
G. Savoia*, M. Loreto**, C. Fittipaldi **
*IV Servizio di Anestesia e Rianimazione Pediatrica- A.O.R.N ."A.
Cardarelli"-Napoli
**Scuola di Specializzazione in Anestesiologia e Rianimazione- Seconda
Università degli studi di Napoli (SUN)
Gli oppioidi sono farmaci comunemente utilizzati in anestesia loco-regionale, svolgono la loro azione interagendo con specifici recettori localizzati in punti strategici del SNC dove modulano la risposta al dolore (sostanza grigia periacquedottale, rafe mediano, sostanza gelatinosa corna posteriori midolli spinale, etc). E’ possibile discriminare farmacologicamente vari tipi di recettori: m, k, d, che presentano diversa distribuzione a livello del sistema SNC (tabella 1):
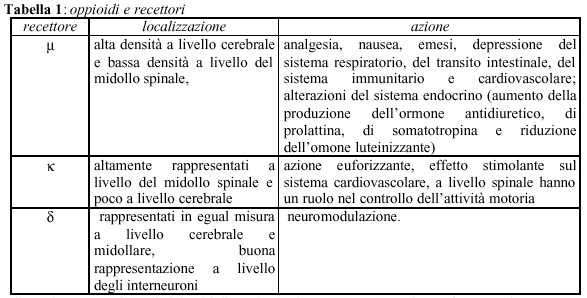
A livello delle corna dorsali del midollo spinale
(specialmente della sostanza gelatinosa) i recettori per
gli oppioidi controllano l’attività dei neuroni encefalinergici discendenti
che modulano la via spinotalamica del dolore (1).
L’iniezione intratecale o extradurale degli oppioidi ha un effetto prevalente
proprio a livello spinale; analgesici forti come morfina,
metadone, fentanyl, sufentanil ed alfentanil sono, infatti,
tutti agonisti dei recettori m.
Caratteristiche farmacocinetiche
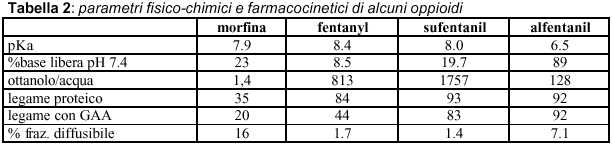
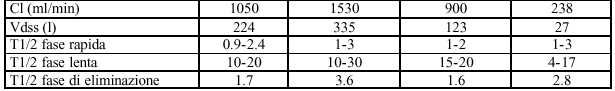
Gli oppioidi sono basi deboli che, in soluzioni acquose, sono dissociati in protoni e basi libere. Tutti gli oppioidi si legano alle proteine plasmatiche, la frazione non-ionizzata e non legata costituisce la frazione diffusibile (tabella 2) (2).
 |
 |
Diversi fattori e principalmente la lipofilia, lo stato di
ionizzazione, la dose, la modalità di somministrazione ed
il volume del farmaco utilizzato sono in grado di modificare i parametri
farmacocinetici (3).
I fattori che influenzano l’onset-time e la durata dell’effetto analgesico
sono la liposolubilità della sostanza utilizzata, la
frazione di dissociazione del farmaco dai recettori e l’accumulo del
farmaco nel grasso peridurale.
Farmaci altamente ionizzati e idrosolubili, come la morfina, somministrati per
via intratecale, raggiungono concentrazioni elevate nel
CSF ma diffondono lentamente ai recettori per gli oppioidi;
nella somministrazione epidurale il comportamento di tali farmaci è
lo stesso ed in più va considerata anche la loro diffusione nello spazio
epidurale; per quanto riguarda la morfina l’assorbimento
in circolo, dopo somministrazione spinale, è rapido ed in
breve tempo essa raggiunge livelli di picco plasmatico; solo piccole quantità
di morfina non ionizzata sono trasportate rostralmente con
il flusso del CFS e aumentano l’effetto analgesico
perché la morfina raggiunge le strutture sopraspinali. La morfina, come paradigma
dei farmaci oppioidi ad elevata idrofilia, presenta quindi: lenta comparsa e lunga
durata dell’azione, diffusione dermatomerica e comparsa di depressione
respiratoria tardiva.
Farmaci liposolubili, ionizzati, si ritrovano a basse concentrazioni nel CSF per
il loro rapido assorbimento sistemico; l’elevata
liposolubilità facilita l’accesso rapido nel midollo spinale dove
legano i recettori per gli oppioidi e siti non specifici ma da cui fuoriescono rapidamente.
Per esempio: il fentanyl (che è ionizzato per più del 90% a ph 7,4) ha una comparsa
più rapida dell’azione ed una durata minore dell’analgesia rispetto alla
morfina, il sufentanil ha una liposolubilità simile a
quella del fentanyl ma essendo meno ionizzato ha una
maggiore durata d’azione per la persistenza nei siti di legame del midollo
spinale e l’elevata affinità per i recettori m.
Considerazione degna di nota è il fatto che i farmaci somministrati
per via epidurale vengono assorbiti rapidamente in circolo attraverso le vene vertebrali
che scaricano nell’azygos, per cui nei soggetti che hanno una pressione intratoracica
aumentata e quindi un flusso spinale aumentatao nella vena azygos, si ha un assorbimento
maggiore del farmaco in circolo mentre una quantità minore resta disponibile
per il trasferimento attraverso la dura al midollo spinale. Per quanto riguarda metabolismo
ed escrezione: gli oppioidi vengono trasformati in gruppi polari ed escreti per via
renale, quelli che presentano gruppi ossidrilici nella loro struttura vengono metabolizzati
per coniugazione con acido glucuronico, gli esteri vengono metabolizzati da esterasi
tissutali.
Importanza delle caratteristiche fisico-chimiche
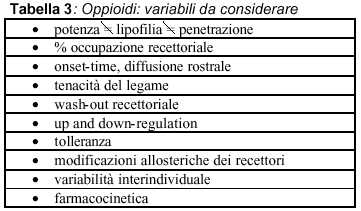
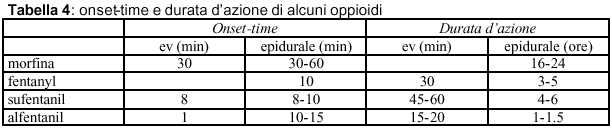
La penetrazione degli oppioidi nel SNC e quindi il legame ai recettori e la possibilità di esplicare le proprie funzioni varia da molecola a molecola, in base alle differenti caratteristiche fisico-chimiche (tabella 3). Per quanto riguarda la liposolubilità è definitivamnete accertato che per o/a da 128 a 560 la diffusibilità risulta essere migliore (fentanyl, sufentanil) , fa eccezione l’alfentanil che possiede bassa liposolubilità compensata però da un piccolo Vdss che gli permette di raggiungere rapidamente concentrazioni plasmatiche all’equilibrio plasma/cervello.
Quali farmaci?
Morfina (pKa 7.9, fraz. diffusibile: 16% a pH 7.4) dopo somministrazione intratecale diffonde al midollo spinale solo una quota pari al 5% e lentamente ai vasi sanguigni circostanti, per questo motivo la scomparsa della morfina dal CSF ha un’emivita di circa 3 ore. Si può avere diffusione rostrale e la morfina può raggiungere i centri che controllano il respiro ed il pavimento del 4° ventricolo, dopo alcune ore dalla somministrazione. Dopo somministrazione epidurale la situazione è più complessa dal momento che l’uptake vascolare è più rapido e la via di diffusione ai recettori spinali è indiretta; occorrono dosi maggiori per raggiungere un’analgesia adeguata e le concentrazioni plasmatiche raggiungono facilmente livelli clinicamente significativi.
Fentanyl (pK 8.4, fraz. diffusibile: 1,7% a pH 7.4) E’ un oppioide caratterizzato da elevata liposolubilità (coefficiente di ripartizione ottanolo/acqua: 813), buon legame proteico (albumine, glicoproteine e lipoproteine). Dopo somministrazione intratecale, la diffusione al midollo della forma non-ionizzata è rapida, diffonde la tessuto grasso e l’uptake sitsemico è relativamente rapido: durata d’azione più breve della morfina e minori rischi di diffusione rostrale). Dopo somministrazione epidurale raggiunge facilmente il CSF e dà analgesia in 10-15 minuti. Sono però necessarie dosi maggiori poiché parte del fentanyl arriva a livello sistemico dai vasi sanguigni peridurali e di qui diffonde ai tessuti per cui le concentrazioni plasmatiche si mantengono comunque basse.
Sufentanil (pKa 8.0, fraz. diffusibile: 1.4% a pH 7.4) Tra tutti gli oppioidi disponibili è quello che presenta la più alta specificità per i recettori m, ha una potenza 8-10 volte maggiore del fentanyl.. Presenta elevata liposolubilità e grande affinità per le proteine plasmatiche. Ha un volume di distribuzione (Vd) simile al fentanyl ma emivita più breve.
Alfentanil (pKa 6.5, fraz. diffusibile: 7.1%) L’alfentanil differisce dagli altri oppioidi per particolari caratteristiche: rapido onset-time e breve durata d’azione; anch’esso come il sufentanil è un potente m-agonista e ha un buon legame alle proteine plasmatiche.
Quale via?
La tecnica di somministrazione spinale degli oppioidi (sia
essa epidurale, subaracnoidea o intraventricolare) può
essere eseguita attraverso catetere percutaneo o tunnellizzato, collegato,
a sua volta, ad un terminale esterno, ad una porta sottocutanea o ad una pompa sottocutanea
totalmente impiantata, e permette l’infusione del farmaco in maniera continua o
intermittente (boli), o PCEA (con o senza infusione continua) in fase intra e postoperatoria
(gestione del dolore).
La scelta tra somministrazione epidurale o subaracnoidea è determinata dalle
condizioni fisiche del paziente (età, stato di coscienza,
osteoartrosi, assetto emocoagulativo, etc), dall’abilità
dell’esecutore, dalla durata e dal tipo di intervento (urgente o d’elezione)
a cui deve essere sottopposto. La comparazione dei dati,
derivanti da studi condotti per valutare l’efficacia
analgesica dopo somministrazione di oppioidi per via epidurale o subaracnoidea o
intracerebroventricolare, suggerisce pari efficacia delle diverse vie di
somministrazione (4-8).
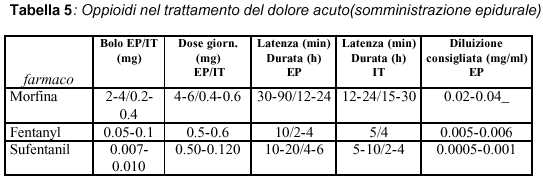
Quale dose?
La dose adoperata per la somministrazione spinale dipende dal tipo di somministrazione e dalla terapia che viene impostata, essa viene modificata in base all’effetto prodotto ed alla tossicità:
epidurale: 20% della precedente dose sistemica (mg/24 hr);
subaracnoidea: 2% della precedente dose sistemica (mg/24 hr);
Sono stati condotti anche trials clinici per valutare l’efficacia della somministrazione spinale di soli oppioidi oppure di oppioidi in associazione ad altri farmaci, la combinazione di oppioidi ad analgesici non-oppioidi e talora ad anestetici locali è risultata più efficace in particolare per il controllo del dolore neuropatico o di tipo acuto, i dati non sono comprensivi, però, della tossicità legata a questi tipi di associazioni (6, 9-14).
Misure di sorveglianza
Secondo le linee guida SIAARTI sul controllo del dolore postoperatorio sono da prendere in considerazione le seguenti misure di sorveglianza (15-20):
II livello
Si raccomanda:
III livello
Si raccomanda: ricovero in ambiente protetto ove vi sia la possibilità di monitoraggio orario
Va adottato un programma di informazione ed educazione permanente del personale (medico e non medico) che deve essere in grado di riconoscere prontamente e trattare con tempestività ed efficacia l’insorgere di effetti collaterali e/o di gravi, anche se rarissime, complicanze come le sindromi compartimentali, la migrazione intratecale del catetere peridurale, l’ematoma peridurale e l’ischemia midollare.
Gli oppioidi sono utili per migliorare l’outcome?
Non vi sono, allo stato attuale, evidenze scientifiche che
dimostrino un outcome migliore nei pazienti trattati con
oppioidi spinali da soli nei confronti dei pazienti trattati con anestetici
locali in associazione o meno con oppioidi; è certamente dimostrata la superiorità
"clinica" delle associazioni tra anestetici locali a bassa
concentrazione ed oppioidi a basse dosi in termini di
ripresa della mobilità, dell’alimentazione, di ridotta incidenza
di infezioni respiratorie e di riduzione dei costi e delle degenze in Unità di Terapia
Intensiva (21).
Infine, in termini di sicurezza, è confermata la bassa incidenza di effetti
collaterali imputabili all’uso degli oppioidi per via
spinale.
Bibliografia
1. Mather LE. Trends in the pharmacology of opioids:
implications for the pharmacotherapy of pain. European
Journal of Pain 2001; 5 (suppl. A): 49-57.
2. Bovill JG. Pharmacokinetics and pharmacodynamics of opioid agonists. Anesth. Pharmaccol.
Rev, 1993; 1: 122-134.
3. Sosnowski M. New concepts in opioid pharmacology. Refresher Course
Lectures-European Society of Anaesthesiologists. Nice, 6
-9 April 2002: 187-192.
4. Panerai AE, Bianchi M, Ferrario P, Sacerdote P. Opioids. In: Regional
anaesthesia, analgesia and pain managementdi M. Tiengo,
V.A. Paladini e N. Rawal. Sprinter-Milano 1999.
5. Cousin MJ, Suellen MW. Neural blockade and pain management. In Pain 1999- An Update
review. Seattle IASP Press; 289-291
6. Carr DB, Cousins MJ. Spinal route of analgesia. In Neural blockade in
clinical anesthesia and management of pain. Third Edition,
Philadelphia 1998; 29: 915-975.
7. McArdle CS. Continuous and patient-controlled analgesic infusions. In: Doyle
Ed 1986 International symposium on Pain Control. Royal
Society of Medicine International Symposium Series N°
123: 17-22.
8. Ready LB, Loper KA, Nesslt M. Epidural morphine is safe on surgical wards. Anesthesiology
1991; 75:452-56.
9. Dougherty PM, Staats PS. Intrathecal drug therapy for chronic pain.
Anesthesiology 1999; 91: 1891-918.
10. International Associate for the Study of Pain. Management of Acute Pain: A Practical
Guide, Task Force on Acute Pain, Edited by Ready LB, Edwards WT. Seattle,
IASP, 1999.
11. Sidebotham D, Dijkhuizen MR, Schug SA. The safety and utilization of patient
controlled analgesia. J Pain Symptom Manage 1997 Oct;
14(4): 202-9.
12. Wielbalck A, Bridner G, Van Aken H. The effects of adding sufentanil to
bupivacaine for postoperative patient controlled epidural
analgesia. Anesth Analg 1997; 85: 124-29.
13. De Kock M, Wiederkher P, Laghmiche A, Scholtes JL. Epidural clonidine used
as the sole analgesic agent during and after abdominal
surgery. A dose-response study. Anesthesiology 1997;
86(2):285-92.
14. Paech MJ, Pavy TJ, Orlikowski CE, Lim W, Evans SF. Postoperative epidural infusion:
a randomized, double-blind, dose-finding trial of clonidine in combination with
bupivacaine and fentanyl. Anesth Analg 1997 Jun; 84(6):1323-8.
15. Nolli M; Nicosia F. La gestione del dolore postoperatorio. Obiettivi,
Identificazione e organizzazione delle procedure di
sviluppo di un programma di terapia del dolore acuto
postoperatorio. Minerva Anestesiol 2000 Sep;66(9): 585-601.
16. Ready LB, Ashburn M, Caplan RA, Carr DB, Connis RT, Dixon CL, Hubbard L,
Rice LJ. Practice guidelines for Acute Pain Mangement in
the Perioperative Setting – a report of the American
Society of Anesthesiologists Task Force on Pain Management,
Acute Pain Section. Anesthesiology 1995; 82:1071-81
17. Ready LB, Ashburn M, Caplan RA, Carr DB, Connis RT, Dixon CL, Hubbard L.Rice
LJ. Practice guidelines for Acute Pain Mangement in the
Perioperative Setting – A report of the American Society
of Anesthesiologists Task Force on Pain Management, Acute
Pain Section. Anesthesiology 1995; 82:1071-81.
18. Ballantyne JC, Carr DB, deFerranti S, Suarez T, Lau J, Chalmers TC,
Angelillo IF, Mosteller F. The comparative effects of
postoperative analgesic therapies on pulmonary
outcome: cumulative meta-analyses of randomized, controlled trials. Anesth
Analg 1998 Mar; 86(3): 598-612.
19. Stacey BR, Rudy TE, Nelhaus D. Management of patient-controlled analgesia: a
comparison of a primary surgeon and dedicated pain service.
Anesth Analg 1997; 85 (1):130-34.
20. International, association for the Study of Pain. Analgesic tolerance to
opioids. Pain Clinical Updates, 2001; IX, 5: 1-4.
21. Rodgers R et al."Reduction of postoperative mortality and morbidity
with epidural or spinal anaesthesia: results from overview
of randomised trials". British Medical Journal 2000;
321: 1493-7.
2 - FARMACI ADIUVANTI IN ANESTESIA REGIONALE
P. De Negri, P. Modano, T. Tirri, G. Ciampo - U.O.
Anestesia, Rianimazione e Terapia Antalgica
Centro di Riferimento Oncologico della Regione Basilicata - Ospedale Oncologico
Regionale
Rionero in Vulture (PZ)
L’anestesia regionale si basa sulla somministrazione di anestetici locali che nella fase perioperatoria assicurano :
Purtuttavia alcuni dei suddetti fenomeni possono rivestire un
aspetto negativo nel periodo postoperatorio: il blocco
motorio rappresenta un elemento sfavorevole se si richiede
una mobilizzazione precoce; il blocco parziale dell’attività
simpatica può essere causa di ipotensione.
Sono stati quindi utilizzati vari adiuvanti per consentire la riduzione del dosaggio
degli anestetici locali e quindi degli effetti collaterali ad essi secondari.
Prima di somministrare un nuovo farmaco per via spinale, sono comunque richieste
numerose valutazioni tossicologiche sugli animali.
Il primo adiuvante ed il più largamente utilizzato è rappresentato dall’adrenalina,
seguito quindi dagli oppioidi, dagli alfa 2 adrenergici agonisti (clonidina),
dagli inibitori delle colinesterasi (neostigmina), dai NMDA antagonisti,
dall’adenosina; gli adiuvanti sono stati utilizzati da soli e/o in aggiunta
agli anestetici locali sia nei blocchi centrali che nei blocchi nervosi periferici.
BIBLIOGRAFIA
1. Eisenach JC, et al. Alpha2-adrenergic agonists for regional
anesthesia. A clinical review of clonidine (1984-1995).
Anesthesiology 1996; 85:655-74
2. Filos KS, et al. Hemodynamic and analgesic profile after intrathecal clonidine
in humans. A dose-response study. Anesthesiology 1994; 81: 591-601
3. Chiari A, et al. Analgesic and hemodynamic effects of intrathecal clonidine
as the sole analgesic agent during first stage of labor: a dose-response study.
Anesthesiology 1999; 91:388-96.
4. Mercier FJ, et al. The effect of adding a minidose of clonidine to intrathecal
sufentanil for labor analgesia. Anesthesiology 1998; 89:894-601
5. De Kock M, et al.: Epidural clonidine or bupivacaine as the sole analgesic
agent during and after abdominal surgery: a comparative study.
Anesthesiology 1999; 90:1354-62
6. Hood DD, et al. Phase I safety assessment of intrathecal neostigmine methylsulfate
in humans. Anesthesiology 1995; 82:331-43
7. Liu SS, et al. Dose-response effects of spinal neostigmine added to bupivacaine
spinal anesthesia in volunteers. Anesthesiology 1999; 90:710-7
8. Lauretti GR, et al. A multi-center study of intrathecal neostigmine for analgesia
following vaginal hysterectomy. Anesthesiology 1998; 89:913-8.
9. Himmelseher S et al., Small-dose s (+)-ketamine reduces postoperative pain
when applied with ropivacaine in epidural anesthesia for total knee arthroplasty.
Anesth Analg 2001;92:1290-1295
10. Subramaniam B, et al. Preoperative epidural ketamine in combination with
morphine does not have a clinically relevant intra- and postoperative opioid-sparing
effect. Anesth Analg 2001;93:1321-1326
11. Wu CT, et al. Pre-incisional epidural ketamine, morphine and bupivacaine
combined with general anaesthesia provides pre-emptive analgesia
for upper abdominal surgery. Acta Anaesthesiol Scand 2000; 44:
63–8.
12. Wong CS et al.Ketamine potentiates analgesic effect of morphine in postoperative
epidural pain control. Reg. Anesth. 1996; 21:534-41
13. Hager H, et al. Caudal clonidine prolongs analgesia from caudal S(+)-ketamine
in children. Anesth Analg 2002 94:1169-72
14. Mizuno J,et al. Usefulness of epidural administration of ketamine for relief
of postherpetic nevralgia Masui 2001; 50:904-7
15. De Negri P,et al. How to prolong postoperative analgesia after caudal anaesthesia
with ropivacaine in children: S-ketamine versus clonidine. Paediatr
Anaesth 2001 ;11:679-83
16. Shiraishi M, et al.A safe anesthetic method using caudal block and ketamine
for the child with congenital myotonic dystrophy. Anesth Analg 2002
;94:233
17. Lee IO et al No enhancement of sensory and motor blockade by ketamine
added to ropivacaine interscalene brachial plexus blockade. Acta
Anaesthesiol Scand 2002 ;46:821-6
18. Eisenach JC, et al. Preliminary efficacy assessment of intrathecal injection
of an American formulation of adenosine in humans. Anesthesiology
2002 ;96:29-34
19. Belfrage M et al. The safety and efficacy of intrathecal adenosine in patients
with chronic neuropathic pain. Anesth. Analg. 1999;89:136-42