_______________________________________________________
ESRA 2002 Italian Chapter - Relazioni
3 - Day surgery: criteri di dimissione ed outcome
Y. Leykin, M. Lucca, A. Ferramosca*
2° Servizio d’Anestesia e Rianimazione,
* S.O.S. Day Surgery Sacile,
Azienda ospedaliera "S. Maria degli Angeli", Pordenone
La chirurgia in regime di "day surgey"
ha visto una notevole espansione nell’ultimo decennio
in Italia e nel mondo.Parallelamente si è verificato un aumento della complessità
degli interventi proposti e un’estensione delle indicazioni anche a pazienti
in condizioni generali non ottimali.(1.)
Gli indiscutibili vantaggi di questo modello organizzativo sono:
- Minori costi sanitari
- Riduzione delle liste di attesa
- Gradimento per gli utenti.
Tempi di ricovero contenuti sono particolarmente ben accetti ad alcune categorie
di pazienti,come i bambini,dove è frequente
osservare disturbi psicologici e comportamentali
dopo ospedalizzazione (2). I pazienti pediatrici, generalmente sani, da
sottoporre ad interventi di piccola-media chirurgia sono quindi candidati ideali
per la chirurgia ambulatoriale.Non sorprende
che negli Stati Uniti, dove la chirurgia ambulatoriale
è estesamente praticata, oltre il 60% della chirurgia pediatrica viene eseguita
con questa modalità.(3).
La compressione dei tempi di degenza deve però conciliarsi con una elevata
qualità della prestazione erogata e
sicurezza per il paziente, riducendo al minimo le complicanze
postoperatorie e le riospedalizzazioni. E’evidente infatti che, complicanze
postoperatorie minori quali vomito o dolore, facilmente trattabili in ospedale,
possono diventare un problema di difficile gestione e fonte di insoddisfazione
per il paziente, dopo che questi è ritornato a casa. Molta
attenzione è stata pertanto rivolta alla ricerca di tecniche anestesiologiche
che consentano un rapido recupero per il
paziente, con scarsi effetti collaterali postoperatori
e alla definizione degli aspetti concernenti la dimissione dei pazienti trattati
in "day surgery".
La dimissibilità dopo intervento è condizionata da diversi fattori interagenti
tra loro: condizioni cliniche preoperatorie
del paziente, tipo di intervento e tecnica chirurgica, tipo
di anestesia, andamento del decorso postoperatorio, ecc.
Da un punto di vista organizzativo, in accordo con le linee guida sulla
"day surgery"italiane(SIAARTI/AAROI
1997), americane(ASA) e francesi (Societè Francaise
d’Anesthèsie Réanimation,1993) è opportuno che:
Interventi chirurgici in "day surgery"
possono essere eseguiti in anestesia locale +/- sedazione,in
anestesia locoregionale (spinale, peridurale, plessica) o in anestesia generale.
Ma quando si può considerare dimissibile il paziente dal punto di vista
clinico?
In tal senso, adottare criteri puramente temporali per la dimissione dei
pazienti, pur presentando una evidente
praticità organizzativa,è limitativo perché non considera la variabilità
dei pazienti e delle tecniche anestesiologiche impiegate. E’preferibile adottare"criteri
obbiettivi", ovvero indicare dei requisiti minimi di autonomia che il paziente
deve soddisfare per essere dimesso. Genericamente si può ritenere che il paziente
può ritornare a casa quando sono cessati gli effetti dell’anestesia, in
assenza di complicanze chirurgiche,dolore mal
controllato o sintomatologia che provochi disagio
come nausea,vertigini ecc.
Korttila ha stabilito delle linee guida per una dimissione sicura che
comprendono la valutazione clinica di più
parametri. Oltre al pieno recupero di segni vitali, il paziente deve
essere orientato nel tempo e nello spazio, capace di vestirsi da solo e di camminare
senza assistenza; non deve inoltre avere vomito e nausea se non minimi, il dolore
deve essere controllabile e non deve eserci sanguinamento dalla ferita chirurgica.
Il paziente deve essere accompagnato a casa da un adulto responsabile e devono
essergli consegnate precise istruzioni riguardanti il periodo postoperatorio, che
egli deve mostrare di aver compreso e sottoscritto. L’abitazione del paziente
deve trovarsi entro un’ora di viaggio dal
centro dove l’intervento è stato eseguito ed egli deve
disporre di un mezzo di trasporto adeguato con il quale l’accompagnatore
potrà ricondurlo in ospedale (4).
Dopo anestesia generale, il recupero è un processo continuo che si completa
quando il paziente ritorna alle proprie
condizioni fisiologiche preoperatorie. Ciò può richiedere
anche diversi giorni. Schematicamente si possono individuare tre fasi successive(4)
Nella I fase il paziente viene monitorizzato
nella presala o nella Recovery Room da personale
altamente specializzato.Molto utile, in questa fase iniziale di recupero, la valutazione
clinica col Postanesthetic Recovery Score di Aldrete.(5). Nella sua versione
originale del 1970, questo sistema di valutazione a punteggio prevede l’assegnazione
di un valore numerico tra 0 e 2 a ciascuno dei cinque parametri esaminati:attività
motoria, respiro, pressione arteriosa, coscienza e colorito della cute.
Solo quando il paziente raggiunge un punteggio totale pari a 9 può essere inviato
al reparto di degenza.Con l’impiego quasi routinario del pulsossimetro nel monitoraggio
postoperatorio è stata proposta una variante alla scala di Aldrete che utilizza
il dato della SaO2 al posto della valutazione clinica per giudicare l’ossigenazione
periferica.(6). In alternativa,utilizzata
anche in ambito pediatrico, la scala di Steward (7), che considera
tre parametri a cui viene assegnato un punteggio tra 0 e 2:coscienza, attività respiratoria
e motilità. L’impiego di nuovi agenti
anestetici a breve durata di azione (propofol, remifentanil,
desflurano, sevoflurano),le innovazioni tecniche nella gestione delle vie aeree
(LMA versus IOT),la comparsa sul mercato di sofisticati sistemi di monitoraggio
che consentono una migliore titrazione dei farmaci dell’anestesia (BIS –
bispectral index), consentono oggi,in molti casi, un pronto risveglio del
paziente già in sala operatoria e il suo
immediato trasferimento in reparto, bypassando la fase di osservazione
in Recovery Room (Fast Tracking). In
letteratura vengono oggi proposti quindi anche criteri per giudicare se il
paziente, a fine intervento, può affrontare
questo "percorso accelerato"e passare direttamente in reparto.(8)
Durante la successiva fase del recupero (fase II o intermediate recovery), il
paziente in genere comincia a camminare,a
bere,a urinare e si prepara per la dimissione. In questa
fase è molto importante,anche per ragioni medico-legali,disporre di criteri obbiettivi
e codificati per decidere la dimissibilità del paziente, che è comunque, come
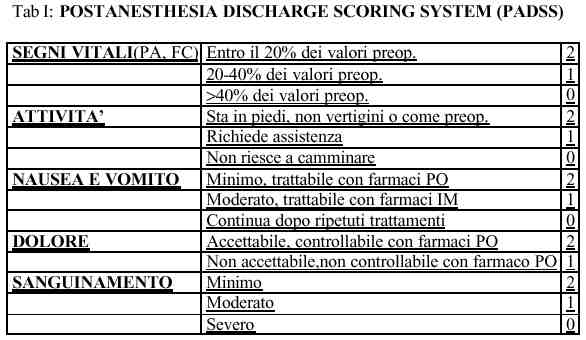
sottolineato in precedenza, sotto responsabilità medica.Nella tabella I viene riportato
il Postanesthesia Discharge Scoring System (PADS) proposto da Chung, tra i
più utilizzati in ambito clinico(9,10) Nell’attuale
versione vengono presi in considerazione 5 parametri:segni vitali, attività motoria,nausea
e vomito, dolore, sanguinamento chirurgico.A ciascun parametro viene assegnato
un punteggio compreso tra 0 e 2. Il punteggio totale massimo realizzabile è 10
e, un punteggio di almeno 9 è necessario per dimettere il paziente. Applicando
il PADS nel proprio centro di chirurgia
ambulatoriale, Chung ha osservato che l’82% dei
pazienti risulta dimissibile entro 2 ore dall’intervento e il 95,6% entro 3 ore.Raggiunti
i criteri per la dimissione alcuni pazienti ritardano l’effettiva dimissione
per motivi non medici (accompagnatore non presente) o per ripresa della sintomatologia
dolorosa.Solo il 4,4% dei pazienti ha un ricovero più prolungato per cause
varie:dolore, nausea e vomito, ipotensione, sanguinamento, vertigini,
difficoltà a ad urinare.Il tipo di
intervento influenza la durata del ricovero e la probabilità di complicanze
postoperatorie. Non vengono, in genere,più
ritenuti requisiti indispensabili per la dimissione in chirurgia
ambulatoriale, la capacità di bere e urinare.Se la presenza di vomito è chiaramente
incompatibile con la dimissione del paziente, si è visto infatti che, forzare il
paziente ad assumere liquidi, può, di per se, essere causa di vomito e di
aumento dei tempi di degenza.Ciò è stato
dimostrato nei pazienti pediatrici.(11).Anche negli adulti,uno
studio randomizzato che confronta soggetti forzati a bere rispetto a soggetti
lasciati liberi di assumere liquidi a piacimento, mostra la stessa frequenza di nausea
e vomito postoperatorio,con tempi di ricovero più brevi per il secondo gruppo. (12).
Analogamente non sembra indispensabile
attendere che il paziente urini prima della dimissione
se non sussistono condizioni che comportano un aumentato rischio di ritenzione
urinaria postoperatoria (anestesia spinale o peridurale, interventi pelvici o urologici,precedenti
episodi di ritenzione urinaria).(13)
I pazienti sottoposti ad anestesia loco-regionale richiedono una osservazione postoperatoria
analoga a quella dei pazienti trattati con anestesia generale,anche se diversi
Autori hanno riportato tempi di ricovero più brevi (14, 15). Sono necessarie, per
la dimissione, alcune verifiche aggiuntive:
Per valutare l’outcome dei pazienti sottoposti
a chirurgia in regime di "day surgey"
è importante prendere in considerazione, non solo mortalità e morbilità, ma
anche altri parametri quali la durata della degenza postoperatoria, i ricoveri non
pianificati,le eventuali successive riospedalizzazioni e il grado di soddisfazione
dei pazienti. In questo tipo di chirurgia la
mortalità e le complicanze maggiori sono molto rare.In
una casistica di Warner,pubblicata nel 1993 e riguardante oltre 38000 pazienti
operati in regime ambulatoriale e controllati per 30 giorni dopo l’intervento,
si registravano solo 4 casi di decesso (2 dovuti a IMA e 2 per incidente
stradale) e 31 casi di complicanze maggiori (0.08%) :infarto miocardico, ictus,
embolia polmonare e insufficienza respiratoria.(17).
Il tipo di intervento e la comparsa di complicanze quali dolore eccessivo, PONV,vertigini
e problemi cardiovascolari, hanno la massima influenza sulla durata
della degenza postoperatoria. I pazienti con insufficienza cardiaca e quelli sottoposti
ad interventi chirurgici più lunghi sono a maggior rischio di ricovero prolungato(18).
La percentuale di ricoveri non pianificati è
considerata un buon indicatore della frequenza
di complicanze maggiori e varia in letteratura tra lo 0.3 e l’1.4%(18, 19,
20) del totale di interventi ambulatoriali e 1 su 12.550 è il tasso delle riospedalizzazioni
con pericolo di vita per il paziente. La percentuale dei problemi legati
all’anestesia sono compresi tra il 15% e 30%, quelli chirurgici fra il 30% e 40%
e la restante percentuale è legata a problematiche sociali. Nausea e vomito sono
le più frequenti complicazioni che rendono necessaria l’ospedalizzazione, soprattutto
in campo pediatrico.
NOSTRA ESPERIENZA
Presso il presidio ospedaliero di Sacile facente parte dell’Az.Osp. di Pordenone è stata istituita da alcuni anni un struttura di day surgery multidisciplinare con le seguenti caratteristiche:
Sale operatorie e spazi per la degenza dedicati.
Personale dedicato.
Autonomia gestionale ed organizzativa.
In essa confluiscono attività chirurgiche di diverse unità operative secondo turni prestabiliti sulla base di protocolli concordati.
L’attività di day surgery si esplica dalle ore 7.00 alle ore 18.00 per 5 giorni alla settimana.
Non è previsto pernottamento.
Tutti i pazienti afferenti alla day surgery sono selezionati secondo i seguenti criteri:
Come CRITERIO DI DIMISSIONE abbiamo applicato le linee guida di Kortilla così modificate:
Il paziente viene valutato entro le ore 18.00 sia dal chirurgo che dall’anestesista, per quanto di loro competenza e quindi dimesso accompagnato da un parente e munito di istruzioni scritte e terapia per il postoperatorio. In caso non siano soddisfatti i criteri di dimissibilità il paziente viene osservato per ulteriori due ore (dimissioni ritardate) e se persiste l’impossibilità alle dimissioni viene ricoverato per il pernottamento e rivalutato il mattino dopo.(ricovero non programmato).
Casistica
Dal 1999 al 2001 sono stati eseguiti nella nostra struttura un totale di 5354 interventi in day surgery, così suddivisi:
Chirurgia generale: 949 in prevalenza interventi per flebopatie arti inferiori ed ernia inguinale
Oculistica: 1109 esclusivamente interventi per cataratta
Ortopedia: 3296 in prevalenza interventi sull’arto superiore
Al fine di valutare l’efficacia dei criteri di
dimissione da noi adottati, abbiamo preso in
esame gli interventi eseguiti dal 1999 al 2001 dalle due divisioni di chirurgia
generale, limitatamente agli interventi per varici agli arti inferiori e per ernia
inguinale eseguiti in anestesia subaracnoidea o locoregionale con sedazione.
Di tali interventi abbiamo valutato: - tipo
di intervento e tipo di anestesia - età dei
pazienti - le dimissioni ritardate -
i ricoveri non programmati
TIPO DI INTERVENTO E TIPO DI ANESTESIA
| VARICI: | 632 | 470 Anestesia Subaracnoidea 146 Anestesia Locale + sedazione 16 Anestesia L.R. (B. Sciatico+Femorale) |
| ERNIA INGUINALE: | 206 | 203 Anestesia Locale + sedazione 3 Anestesia subaracnoidea |
ETA’ DEI PAZIENTI
> 60 anni 25%
>50<60 anni 30%
>40<50 anni 23%
>30<40 anni 20%
<30 anni 2%
DIMISSIONI RITARDATE (oltre le 18.00)
| 1999 | 2000 | 2001 | TOTALE 69 (8%) |
| 32 | 25 | 12 |
Cause:
14 dolore postoperatorio
22 instabilità emodinamica
16 mancata regressione blocco anestesiologico
17 problemi organizzativi (assenza dell’accompagnatore)
RICOVERI NON PROGRAMMATI
| 1999 | 2000 | 2001 | TOTALE 19 (2,2%) |
| 8 | 6 | 5 |
Cause:
14 cefalea
3 instabilità emodinamica
1 mancata regressione del blocco anestesiologico
1 T.I.A.
Per 15 di questi pazienti non si è potuto procedere alle dimissioni ed è stato necessario il ricovero per pernottamento, 4 sono stati ricoverati il giorno dopo per comparsa di cefalea importante dopo anestesia subaracnoidea.
CONCLUSIONI
In conclusione l’obbiettivo futuro
sarà quello di ottenere un alto grado di soddisfazione
dei pazienti e una precoce e completa ripresa funzionale una volta che
il paziente è ritornato a casa. E’ fondamentale però non basarsi solo su
criteri numerici, ma anche su giudizio
clinico individuale e di programmare i percorsi non
solo in funzione di logica economica, ma anche sulle convenienze cliniche e di
sicurezza.
Nella nostra casistica l’assenza di complicanze importanti e l’esiguo numero
di pazienti ricoverati dopo le dimissioni
(quattro), ci conferma la validità dei criteri di
dimissione da noi adottati se accompagnati da una attenta selezione dei
pazienti.

BIBLIOGRAFIA
4 - Regional anaesthesia and vascular surgery
La rachianestesia non presenta vantaggi evidenti nella conduzione intraoperatoria in chirurgia vascolare, e sottende pericoli nel postoperatorio immediato
Marco Dei Poli
Servizio di Anestesia Polispecialistica e
Rianimazione – Istituto Policlinico San Donato
Vantaggi e svantaggi della rachianestesia nel
periodo intra e postoperatorio sono stati argomento
di discussione – come in questo confronto pro e contro – in letteratura
chirurgica e anestesiologica, a partire
almeno dalle considerazioni di Yaeger nel 1987 (1).
Nell’ambito della chirurgia vascolare - aortica, carotidea o periferica – si
dà spesso per scontato che i vantaggi della
rachianestesia siano stati ben dimostrati e che pertanto
tale tecnica – epidurale, spinale o combinata spino peridurale – sia non
solo sicura, ma addirittura da preferire
sempre, a meno di controindicazioni evidenti, da sola
o nell’ambito della blended anesthesia.
I supposti vantaggi sono innanzitutto in termini di miglioramento dell’outcome.
Nessuno studio attualmente disponibile è in
grado di dimostrare una ridotta mortalità per
eventi cardiaci, polmonari od infettivi nel confronto fra gruppi di pazienti
sottoposti a rachianestesia vs. anestesia
generale. La potenza degli studi disponibili
è comunque inadeguata nei confronti di eventi di bassa
incidenza quali la mortalità e l’infarto miocardico. Lo
studio di Bode et al, nel 1996, incapace di dimostrare differenze significative
fra gruppi di pazienti sottoposti ad
anestesia generale o rachianestesia, nei riguardi di mortalità
intraospedaliera, incidenza di infarto miocardio, angina e scompenso, è stato
interrotto quando le analisi di potenza statistica hanno dimostrato la
necessità di arruolare almeno 24mila
pazienti… (2)
Ogni commento a riguardo della rachianestesia come tecnica di anestesia va
tenuto ben distinto dalle valutazioni a
riguardo dell’analgesia postoperatoria condotta con somministrazione
di analgesici per via epidurale continua: nell’ambito stretto della chirurgia
vascolare – aortica o periferica – ci pare possibile sostenere indubbi vantaggi
di quest’ultima nei confronti dell’analgesia endovenosa in tutte le sue modalità
di somministrazione (demand, continua, PCA). D’altra
parte mancano ancora evidenze chiare sul ruolo preventivo che la rachianestesia
come tecnica anestetica può avere sull’outcome chirurgico. E’
stato suggerito che l’impiego dell’anestesia epidurale potesse influenzare positivamente
la pervietà dell’impianto protesico nelle fasi precoci postoperatorie, grazie
ad una minor ipercoagulabilità del sangue. Uno
degli studi più recenti e consistenti per numero di pazienti (3) non è stato
in grado di dimostrare differenze
significative per anestesia generale ed epidurale nelle quote
rispettive di trombosi precoce della protesi, che rimangono più facilmente attribuibili
a fattori convenzionali come il difficoltoso efflusso della vascolarizzazione a valle
e/o specifiche difficoltà tecniche. Alle
stesse conclusioni giunge Grass (4) in una recente review sull’outcome postoperatorio:
solo studi prospettici randomizzati multicentrici potranno stabilire un eventuale
effetto positivo della rachianestesia sull’outcome.
E’ possibile che parte della diatriba trovi
un punto di equilibrio nel fatto che vantaggi fisiopatologici
previsti e spesso dimostrati non si traducano in modificazioni statisticamente
significative degli outcome principali o surrogati. Una
metanalisi informale dei 4 studi principali su questo argomento indica che le differenze
fra anestesia generale ed epidurale sono – se presenti – di modesta entità.
Per quanto attiene un secondo item – la stabilità emodinamica – la
valutazione si embrica con quella di
pertinenza cardiochirurgica, in quanto le medesime argomentazioni
hanno creato i presupposti per l’impiego della anestesia/analgesia epidurale
in corso di chirurgia cardiaca. La
modulazione simpatica ottenibile con il blocco simpatico toracico (non prendiamo
in considerazione livelli di blocco inferiori
a T4-T6) riduce la risposta allo stress chirurgico
durante tutta la fase perioperatoria. Sono
state riportate diminuite concentrazioni di cortisolo plasmatico e ridotta eliminazione
urinaria di epinefrina e norepinefrina in pazienti in cui la conduzione intra e
postoperatoria ha fruito dell’anestesia/analgesia epidurale. (5) Anche
nella fase che precede il cross clamping aortico l’outflow adrenergico è significativamente
superiore in pazienti sottoposti alla sola anestesia generale. (6) L’impiego
dell’anestesia epidurale in chirurgia non-cardiaca è associato ad una riduzione
di episodi tachiaritmici e di ischemia miocardica in pazienti con rischio coronarico
elevato. (7) In più sono dimostrati un calo
delle resistenze vascolari sistemiche e della pressione arteriosa
media, una riduzione della wedge pressure e del consumo di ossigeno miocardico,
per ridistribuzione del flusso senza alterazione del metabolismo locale. Tutto
questo appare in linea con il presupposto di una modulazione positiva dell’attività
adrenergica, libera di manifestare effetti indesiderati in corso di sola anestesia
generale, anche se condotta con dosi elevate di analgesici oppioidi.
E’ a tutti ben evidente la rasserenante – per l’anestesista – stabilità
del grafico di pressione e frequenza che si
osserva nel paziente che riceva rachianestesia sola o in combinazione
ad anestesia generale.
E’ doveroso porsi due domande:
La prima: la modulazione – per riduzione
– dell’attività adrenergica è sempre utile nel contesto
della chirurgia vascolare ?
La seconda ; se lo è, il blocco simpatico di lunga durata che si ottiene con l’anestesia
epidurale ne è la forma migliore ? Una
modulazione farmacologica non può essere più
maneggevole ?
Vogliamo porre l’attenzione sul significato omeostatico dei riflessi
barorecettoriali che impiegano il sistema
nervoso vegetativo e le amine endogene, e sul finalismo della risposta
allo stress. Se da un lato quest’ultima –
in assenza di modulazione – può costituire un fattore di rischio
in pazienti coronaropatici (come quasi sempre sono i pazienti sottoposti a procedure
vascolari), dall’altro la risposta all’emorragia o all’inadeguato
precarico è tutta svolta dai meccanismi
riflessi simpaticomediati. E’ possibile che
un monitoraggio sofisticato intraoperatorio (TEE, cateterismo di Swan Ganz,
volemia con verde indocianina, volume telediastolico ventricolare dx) possa guidare
un adeguamento preciso degli squilibri volemici, ma è altrettanto vero che la stragrande
maggioranza della chirurgia aortica è condotta in assenza di questo tipo di presidi.
In ogni caso è nella fase postoperatoria – specie in quella di recovery
immediato - che si manifestano i rischi
maggiori di eventi avversi: pazienti ad elevato rischio coronarico,
con riempimento quasi mai ottimizzato – in uscita da fasi emorragiche -, quasi
sempre relativamente anemizzati, in corso di rewarming da ipotermia (vasodilatazione
da ris caldamento!), trattati con farmaci anestetici quasi sempre vasodilatatori
e più o meno inotropi negativi, vengono osservati (quanto?) in Sala Risveglio
e poi inviati (quasi sempre) ai Reparti di degenza, fidando su un riadattamento
spontaneo alle condizioni di rischio coronarico.
E’ giusto modulare – in questa fase – l’outflow simpatico? E quanto ?
E’ indubbio che il dolore postoperatorio, così come l’ipotermia, siano essi
stessi potenziali fattori di rischio
coronarico: probabilmente esiste un livello soglia ideale che ottiene
un cutoff dell’outflow adrenergico legato al dolore postoperatorio, senza un’interferenza
pericolosa sui riflessi barorecettoriali di compenso. Certamente
l’attenzione ad un paziente di questo tipo non deve essere abbassata dalla
"sensazione" di tranquillità che può fornire il livello di analgesia
e la regolarità di polso e pressione.
L’armamentario farmacologico – alfa agonisti e beta bloccanti selettivi –
a disposizione dell’anestesista per la
modulazione della reazione allo stress chirurgico, è in continuo arricchimento
(esmololo, mivazerol, dexmedetomidina, etc). La
somministrazione di beta blocco preoperatorio si è dimostrata efficace, in uno
studio prospettico randomizzato di adeguata
potenza, nel ridurre l’incidenza di eventi ischemici
in maniera significativa, (8) L’impiego
della blended anesthesia probabilmente non minimizza i rischi già considerati:
molto probabilmente essa complica il compito interpretativo in caso di gravi
complicanze cardiache o cardiocircolatorie. Un’ipotensione grave e poco responsiva
in un paziente cardiopatico, sottoposto agli effetti inotropo negativi e vasodilatatori
della maggior parte degli anestetici generali, e in cui siano aboliti o fortemente
modulati i meccanismi di vicariazione riflessa, pone all’anestesista quadri interpretativi
risolvibili solo con strumenti sofisticati. Lasciamo
al pro-contro in cardiochirurgia il compito di esplorare l’entità del rischio
di incidenti neurologici legati all’impiego
della scoagulazione e della puntura dello spazio epidurale
(ematomi epidurali).
In conclusione resta un invito forte a giudicare con prudenza l’impiego della rachianestesia
in chirurgia vascolare, maggiore e periferica. I
vantaggi sono possibili ma ancora da dimostrare con evidenze indiscutibili. I
rischi intraoperatori sono soprattutto legati alla difficile gestibilità di
eventi emorragici o di deficit contrattile, e
vanno posti in bilancio con i vantaggi – peraltro non esclusivi della
rachianestesia – della stabilità emodinamica perioperatoria. L’immediato
postoperatorio, già di per sé ad elevato rischio nel paziente vascolare, è reso
ancor più delicato dalla presenza del blocco simpatico indotto dall’anestesia/analgesia
epidurale, se non esiste un’osservazione e monitoraggio intensivo
del paziente. Il miglior outcome invocato a
favore delle tecniche locoregionali manca di dimostrazioni
basate sull’evidenza e rischia di rimanere impressione soggettiva o anedottica.
Restiamo peraltro favorevoli all’area dell’analgesia postoperatoria con somministrazione
di farm aci per via epidurale, e siamo comunque fautori di un monitoraggio
di adeguato livello in chirurgia vascolare aortica e periferica.
Riferimenti bibliografici
Informazioni sulla rivista
ESIA-Italia
EDUCATIONAL SYNOPSES IN ANESTHESIOLOGY and CRITICAL CARE MEDICINE - Italia
costituisce la parte Italiana della versione Americana, pubblicata su Internet
da Keith J Ruskin, Professore di Anestesia alla Università di Yale. I lavori
saranno accettati sia in lingua Italiana che Inglese. In quelli di lingua
Italiana un corposo riassunto in Inglese verrà preparato dalla redazione,
qualora l'autore non fosse in grado di fornirlo. A cura della redazione sarà
inoltre la traduzione in Italiano dei manoscritti inviati in lingua Inglese. La
rivista sarà inviata gratuitamente a tutti quelli che ne faranno richiesta,
inviando il seguente messaggio "Desidero ricevere ESIA versione
italiana" indirizzato a LANZA@UNIPA.IT
La rivista pubblica rewiews e lavori originali
compiuti nei campi dell'anestesia e della medicina critica. I lavori originali
riguardano ricerche cliniche, di laboratorio e la presentazione di casi clinici.
Le reviews includono argomenti per l'Educazione Medica Continua (EMC), articoli
di revisione generale o riguardanti le attrezzature tecniche. ESIA pubblica le
lettere all'Editore contenenti commenti su articoli precedentemente publicati ed
anche brevi comunicazioni. La guida per gli autori può essere consultata
collegandosi al sito ANESTIT all'indirizzo: http://anestit.unipa.it/
utilizzando la sezione riservata ad ESIA-Italia; oppure
può essere richiesta inviando un messaggio a lanza@unipa.it
EDUCATIONAL SYNOPSES IN ANESTHESIOLOGY and
CRITICAL CARE MEDICINE Sezione Italiana
Il numero della rivista è anche ottenibile
attraverso World-WideWeb WWW: l'URL per questo numero di ESIA è: http://anestit.unipa.it/esiait/esit0111.txt
Il nome della rivista è esitaamm, dove aa è l'anno
ed mm il mese (per esempio questo numero è esit0111.txt)
LA REDAZIONE DI ESIA ITALIA
DIRETTORE: Vincenzo LANZA
Primario del Servizio d'Anestesia e Rianimazione Ospedale Buccheri La Ferla
Fatebenefratelli Palermo LANZA@UNIPA.IT
Terapia Intensiva
Antonio Braschi
Primario del Servizio d'Anestesia e Rianimazione 1 - Policlinico S. Matteo -
IRCCS Pavia
Anestesia Cardiovascolare
Riccardo Campodonico
Responsabile dell'Unità di Terapia Intensiva Cardiochirurgica - Azienda
Ospedaliera di Parma ricrob@mbox.vol.it
Anestesia e malattie epatiche
Andrea De Gasperi
Gruppo trapianti epatici / CCM - Ospedale Niguarda - Milano
Medicina critica e dell'emergenza
Antonio Gullo
Professore di Terapia Intensiva - Direttore del Dipartimento di Anestesia e
Terapia Intensiva -Università di Trieste
Anestesia ed informatica
Vincenzo Lanza
Primario del Servizio d'Anestesia e Rianimazione - Ospedale Buccheri La
Ferla Fatebenefratelli - Palermo
Tossicologia
Carlo Locatelli
Direttore del Centro di Informazione Tossicologica Centro antiveleni di
Pavia - Fondazione Scientifica "Salvatore Maugeri Clinica del Lavoro e
della Riabilitazione"- Pavia
Terapia Antalgica e Cure Palliative
Sebastiano Mercadante
Aiuto del Servizio d'Anestesia e Rianimazione -
Ospedale Buccheri La Ferla Fatebenefratelli - Palermo
mercadsa@tin.it