

ISSN 1080-3521
EDUCATIONAL SYNOPSES IN ANESTHESIOLOGY
and
CRITICAL CARE MEDICINE - Italia -
Il giornale Italiano online di anestesia Vol 3 No 10 Ottobre 1998
Vincenzo Lanza, MDServizio di Anestesia e RianimazioneOspedale Buccheri La Ferla Fatebenefratelli Palermo, ItalyE-mail:
lanza@mbox.unipa.it
|
Keith J Ruskin, MDDepartment of Anesthesiology Yale University School of Medicine333 Cedar Street, New Haven, CT 06520 USAE-mail: ruskin@gasnet.med.yale.edu |
Copyright (C) 1997 Educational Synopses in Anesthesiology and Critical Care Medicine. All rights reserved. Questo rivista on-line può essere copiata e distribuita liberamente curando che venga distribuita integralmente, e che siano riportati fedelmente tutti gli autori ed il comitato editoriale. Informazioni sulla rivista sono riportate alla fine |
|
In questo numero:
1 LA FARMACOCINETICA NELLE INTOSSICAZIONI ACUTE
2 ANESTESIA: obbligo di mezzi o di risultati ?
_______________________________________________________
1 LA FARMACOCINETICA NELLE INTOSSICAZIONI ACUTE
_______________________________________________________
L. Manzo, C. Locatelli, M. Tonini
Centro di Informazione
Tossicologica Centro antiveleni di Pavia
Fondazione Scientifica "Salvatore Maugeri Clinica del Lavoro
e della Riabilitazione" Pavia
Tossicocinetica negli avvelenamenti
Avvelenamenti da formulazioni farmaceutiche a lento rilascio
Le applicazioni della farmacocinetica hanno avuto un ruolo importante nella terapia in quanto hanno permesso di estendere la valutazione quantitativa dell'attività dei farmaci, di perfezionare i criteri del loro impiego nell'uomo e di istituire il controllo terapeutico individuale attraverso il monitoraggio farmacologico. La tossicocinetica è una disciplina affine che studia i movimenti delle sostanze esogene introdotte nell'organismo in dosi tossiche. Essa si è sviluppata soprattutto nell'ambito delle discipline sperimentali ma nell'ultimo decennio ha ricevuto crescente attenzione anche da parte dei tossicologi clinici (Rosenberg et al. 1981; Wanke, 1984).
Negli avvelenamenti, i livelli raggiunti dal tossico negli organi bersaglio e il loro andamento nel tempo dipendono dalla dose assunta e dalle caratteristiche dei processi di assorbimento, distribuzione, metabolismo ed eliminazione. L'analisi di questi parametri costituisce pertanto la base per definire gli aspetti quantitativi e temporali della tossicità nel singolo paziente. Essa (a) consente di interpretare i sintomi e di formulare previsioni sul decorso clinico, (b) indica le procedure più adeguate per il "monitoraggio" del tossico nei liquidi biologici, (c) facilita la lettura dei dati chimico-tossicologici nel contesto clinico, (d) aiuta nella scelta degli interventi preventivi, della terapia e delle modalità per il controllo dei suoi effetti.
Prima di esaminare gli aspetti applicativi della tossicocinetica, è utile una premessa sui concetti generali della farmacocinetica clinica. Quest'ultima è descritta talora come "farmacologia quantitativa", in quanto si basa su criteri e modelli che servono a valutare quantitativamente i parametri fondamentali della farmacodinamica, cioè la rapidità, l'intensità e la durata dell'azione (Fig.1)
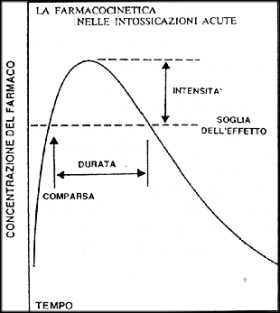 |
| Fig.1. Diagramma che illustra i rapporti tra parametri farmacodinamici e concentrazioni tessutali di una sostanza assunta per via orale. |
Idealmente, il profilo farmacocinetico di una sostanza dovrebbe essere costruito misurando i livelli raggiunti nei distretti dell'organismo che sono sede dell'azione. Tuttavia, poiché l'azione si svolge il più delle volte in sedi non accessibili, si fa ricorso nella pratica alle curve "concentrazione/tempo" ottenute dosando la sostanza in matrici biologiche periferiche quali il sangue o il plasma, l'urina e la saliva.
Dall'analisi dei diagrammi semilogaritmici relativi all'andamento delle concentrazioni plasmatiche nel tempo si ricavano dati quantitativi sulla cinetica di assorbimento e sui processi che caratterizzano la "disposizione", cioè la distribuzione intraorganica e l'eliminazione della sostanza (Fig.2). Modelli matematici consentono lo sviluppo di equazioni che descrivono i livelli della sostanza in funzione del tempo. Si possono così valutare parametri scelti in rapporto alla via di assorbimento e alle caratteristiche proprie della sostanza. Naturalmente, la difficoltà di stimare in modo accurato il profilo cinetico di un composto aumenta con il numero dei parametri da esaminare.
La descrizione dei modelli matematici utilizzati nella farmacocinetica va oltre gli scopi del presente lavoro. Occorre qui ricordare che nei modelli farmacocinetici l'organismo viene rappresentato da una serie di compartimenti che non corrispondono a siti anatomici o fisiologici reali ma costituiscono entità matematiche che descrivono distretti organismici con caratteristiche simili. Vari fattori, tra i quali la perfusione sanguigna e l'affinità per i componenti tessutali, determinano la velocità con cui la sostanza e i suoi metaboliti si spostano da un compartimento all'altro.
In genere, un modello mono-compartimentale è sufficiente per descrivere la cinetica di sostanze che si distribuiscono rapidamente a tutti i liquidi e tessuti dell'organismo. I modelli multi-compartimentali consentono di interpretare cinetiche più complesse, caratterizzate dalla esistenza di "spazi" differenziati nei quali gli equilibri si instaurano più lentamente. In ogni caso, il modello prescelto deve essere quello più adeguato per misurare la velocità dei singoli processi cinetici ed applicare le equazioni differenziali che descrivono le variazioni dei livelli di sostanza in ciascun compartimento.
I parametri farmacocinetici che assumono maggiore importanza nell'ambito tossicologico sono quelli relativi alla distribuzione e alla eliminazione.
Il volume di distribuzione (Vd) è un indice che correla la concentrazione plasmatica o ematica della sostanza alla quantità totale in cui essa è presente nell'organismo. Non corrisponde ad alcuno spazio fisiologico, ma può essere considerato come il volume "apparente" o virtuale in cui si trova disciolta la sostanza assorbita. Nell'uomo adulto può variare da meno di 5 litri (sostanze confinate nel distretto circolatorio) a 40 litri circa (sostanze distribuite in tutta l'acqua corporea), fino a qualche centinaio di litri per le sostanze che si concentrano massivamente nei tessuti. Il volume di distribuzione si calcola mediante l'equazione
| Vd= D/Co |
dove D è la dose e Co la concentrazione plasmatica al tempo zero. Quest'ultima rappresenta la concentrazione che si avrebbe nel circolo se la distribuzione del farmaco fosse istantanea; si ottiene estrapolando all'asse delle ordinate la curva di decadimento plasmatico nel diagramma semilogaritmico che rappresenta le concentrazioni in funzione del tempo (Fig.2).
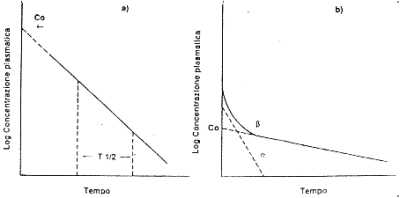 |
| Fig. 2. Diagrammi semilogaritmici che rappresentano modelli farmacocinetici ad un compartimento (a) e a due compartimenti (b). |
Un valore molto piccolo di Co e un Vd elevato sono indici che riflettono la tendenza del composto a diffondere verso un compartimento esterno a quello in cui si è fatto il prelievo (es. sangue), cioè l'attitudine a concentrarsi in organi e tessuti periferici. Fattori che determinano un elevato Vd sono la liposolubilità e la affinità per le proteine plasmatiche e/o tessutali. Conoscendo il volume di distribuzione, è possibile stimare approssimativamente il valore dei livelli ematici raggiungibili con una certa dose di farmaco o, viceversa, stabilire, in base ai livelli ematici misurati, l'entità della dose assunta.
L'eliminazione delle sostanze dall'organismo può avvenire attraverso molteplici vie (rene, intestino, bile, apparato respiratorio, sudore ecc.). Tuttavia, nei modelli farmacocinetici questo parametro viene comunemente espresso misurando la velocità con cui la sostanza è rimossa da un compartimento prestabilito, di solito quello intravasale, per effetto del metabolismo e della escrezione.
L'eliminazione può seguire una cinetica non lineare, detta anche di "ordine zero" oppure una cinetica di "primo ordine". La cinetica di "primo ordine" riguarda le sostanze che vengono eliminate dall'organismo con velocità proporzionale alla dose e alle concentrazioni ematiche. Per la maggior parte dei farmaci assunti in dosi terapeutiche l'eliminazione segue una cinetica di questo tipo.
Un parametro pratico per definire i processi di eliminazione di primo ordine è il tempo di dimezzamento o emivita (T1/2), cioè il tempo necessario perché la quantità o la concentrazione della sostanza assorbita si riduca della metà. Tale parametro è una costante indipendente dalla dose. Nei modelli bicompartimentali può essere calcolato attraverso la formula:
| T1/2 = 0.693/b |
dove b è la pendenza del tracciato che nel diagramma semilogaritmico concentrazione/tempo descrive la fase di eliminazione (Fig.2).
La cinetica di "ordine zero" descrive invece la rimozione delle sostanze che sono eliminate a velocità costante cioè indipendente dalla dose e dalla loro concentrazione ematica. In questo caso l'emivita è proporzionale alla quantità di sostanza inizialmente presente nell'organismo.
Si è già detto che pochi farmaci alle dosi terapeutiche seguono una cinetica di eliminazione di "ordine zero". Questa, invece, è abbastanza comune dopo assorbimento di dosi elevate come conseguenza del fatto che certi processi, in particolare quelli relativi al metabolismo o alla escrezione, sono a capacità limitata e quindi saturabili.
La cinetica di saturazione è una caratteristica che accomuna numerose sostanze di interesse tossicologico (Tabella I) le quali, pertanto, presentano le seguenti proprietà:
| l'emivita nella fase di eliminazione diventa maggiore con l'aumentare della dose |
| a dosi elevate, la curva "livelli plasmatici-tempo" è bifasica, con una fase iniziale di eliminazione lenta seguita da una fase più rapida; a dosi ridotte si osservano invece cinetiche apparenti di "primo ordine" indicanti l'assenza di fenomeni di saturazione (Fig.3) |
| la composizione dei metaboliti può cambiare con la dose |
| nelle intossicazioni miste, la presenza di altri farmaci che agiscono sullo stesso enzima o sullo stesso sistema di trasporto ha influenze marcate sui processi di saturazione. |
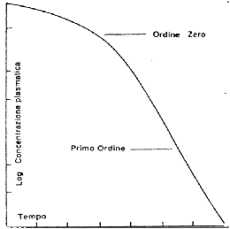 |
| Fig. 3. Rappresentazione della curva livelli plasmatici/tempo di una sostanza la cui eliminazione viene saturata a 100 µg/ml. Oltre questo livello, la sostanza viene eliminata con una cinetica di "ordine zero"; al di sotto di 100 µg/ml l'eliminazione segue una cinetica di "primo ordine". |
Tossicocinetica negli avvelenamenti
I risultati delle terapie adottate nelle intossicazioni acute non sempre sono valutabili con criteri clinici. Lo studio della farmacocinetica fornisce un criterio di valutazione razionale, specie per quanto concerne le procedure intese a modificare l'assorbimento, la distribuzione o la eliminazione dei tossici. Purtroppo, studi di farmacocinetica applicata alla tossicologia clinica sono stati finora condotti solo per un limitato numero di sostanze. Per quanto concerne i farmaci, si fa spesso riferimento ai parametri cinetici misurati in volontari o pazienti dopo somministrazione di dosi terapeutiche. L'estrapolazione di questi dati alla situazione di sovradosaggio può tuttavia condurre a conclusioni erronee e richiede in ogni caso molta cautela (Rosenberg et al. 1981).
Un esempio significativo è fornito dalla cinetica del litio. Nell'intossicazione terapeutica conseguente alla assunzione cronica di sali di litio si osserva un profilo farmacocinetico molto diverso da quello degli avvelenamenti per ingestione accidentale o intenzionale di una singola dose. Nel primo caso l'emivita plasmatica è piuttosto lunga e la tossicità si manifesta precocemente in presenza di litiemie relativalmente basse. Nel secondo, pur essendo la litiemia elevata, i sintomi risultano spesso modesti e si presentano dopo un prolungato periodo di latenza (Dyson et al., 1987). Il litio è un tipico elemento a localizzazione intracellulare che, tuttavia, diffonde con lentezza nei tessuti. Pertanto, dopo una singola ingestione, una frazione considerevole della dose assorbita viene allontanata dall'organismo prima che l'elemento arrivi a concentrarsi negli organi che sono sede della tossicità. Nel soggetto intossicato, l'accertamento farmacocinetico fornisce dati predittivi del decorso clinico e orienta nella scelta della terapia (Rosenberg et al. 1981).
Anche per altre sostanze, il profilo farmacocinetico nel sovradosaggio può differire da quello tipico delle dosi terapeutiche (Rosenberg et al., 1981). Ciò a volte dipende da fenomeni di saturazione dei sistemi preposti al metabolismo o alla escrezione (Mullen, 1980). In altri casi, la cinetica è modificata da fattori quali l'acidosi, l'ipotermia, il danno epatico o renale, l'insufficienza respiratoria o cardiocircolatoria, che spesso sono presenti quali intrinseche espressioni di tossicità della sostanza (Benowitz e Meister, 1976; Blaschke, 1977; McAllister et al., 1978; Benowitz et al., 1979).
(a) Assorbimento L'assorbimento gastro-intestinale dei tossici ha speciale importanza dato che una quota cospicua degli avvelenamenti avviene per ingestione. In certi casi, la cinetica di assorbimento presenta caratteristiche del tutto anomale dopo ingestione di dosi elevate. Ad esempio, negli avvelenamenti da farmaci anticolinergici (antidepressivi triciclici, antiparkinsoniani, ecc.) l'attività propulsiva nel tratto gastro-enterico può essere fortemente depressa, cosicché il tempo di transito e il contatto del farmaco con la superficie assorbente dell'intestino vengono prolungati (Rosenberg et al., 1981). L'assorbimento dei tossici assunti per via orale può essere rallentato nello shock per effetto della alterata perfusione sanguigna nell'intestino. La formazione di aggregati del materiale ingerito (es. compresse) è un altro fattore che, in ragione della ridotta superficie di contatto, può limitare l'assorbimento del tossico nel tratto digestivo.
Varie categorie di sostanze tra cui beta-bloccanti, antidepressivi triciclici, fenotiazine e il metadone, vanno incontro ad un intenso metabolismo pre-sistemico ("first-pass" intestinale e/o epatico) i cui meccanismi vengono saturati ad alte dosi. Dopo ingestione di quantità elevate dei suddetti farmaci, la frazione della dose che giunge in circolo può superare di molto quella attesa in base alla cinetica tipica del dosaggio terapeutico.
L'uso del carbone attivato (Neuvonen, 1982; Dawling et al., 1983; Neuvonen e Olkkola, 1988, Tabella II), l'irrigazione intestinale e il trattamento con purganti, es. sodio solfato, sorbitolo, citrato di magnesio (Shannon et al.,1986), sono talora raccomandati negli avvelenamenti per ingestione allo scopo di limitare l'accesso dei tossici nel compartimento sistemico. Esiste altresì evidenza che il trattamento ripetuto con carbone blocca il circolo entero-epatico o entero-enterale di certe sostanze e aumenta quindi la loro clearance sistemica. Questo vale, ad esempio, per la digossina, il fenobarbitale, la teofillina, la ciclosporina, il methotrexate, il fenilbutazone, la carbamazepina e il diazepam (Pond, 1986; Neuvonen e Olkkola, 1988; Traeger e Haug, 1986; Levy, 1982; Pond et al.,1984).
(b) Distribuzione In presenza di alte concentrazioni plasmatiche di un tossico, il legame che questo contrae con le proteine può essere saturato con conseguente aumento della frazione che circola libera nel plasma. Da ciò derivano importanti implicazioni tossicologiche poiché il volume di distribuzione, la velocità di eliminazione e l'accesso del tossico nei siti recettoriali vengono modificati. Le variazioni dei livelli ematici totali di una sostanza, quali di solito si verificano nel corso dell'avvelenamento, possono modificare l'entità del legame con le proteine plasmatiche facendolo passare dalla saturazione alla desaturazione o viceversa. Cambiano di conseguenza i rapporti tra quota libera e quota legata nonché il volume di distribuzione. Tale fenomeno è uno dei fattori confondenti che rendono talora difficile correlare l'andamento dei livelli ematici totali di un tossico con lo stato del paziente.
Per l'antidepressivo triciclico amitriptilina, la frazione che circola legata con le proteine plasmatiche tende ad aumentare con il pH. E' stato dimostrato che, passando il pH del sangue da 7 a 7.5, il legame proteico aumenta dell'8% e la quantità di farmaco libero presente a livello dei recettori si riduce di 5 volte. Ciò contribuisce a spiegare l'efficacia della alcalinizzazione nella terapia dell'avvelenamento da antidepressivi triciclici (Brown, 1973). In ragione del pH, cambia anche lo stato di ionizzazione dei tossici che hanno caratteristiche di elettroliti deboli. Poiché le membrane biologiche sono molto permeabili alle sostanze lipofile e non ionizzate, i cambiamenti del pH ematico hanno conseguenze importanti nelle intossicazioni acute in quanto modificano la ripartizione del tossico e la sua capacità di diffondere nelle cellule. Un particolare aspetto di questo fenomeno è il potenziamento della tossicità acuta di certi farmaci (barbiturici, amitriptilina, d-propossifene, clormetiazolo) causato dalla concomitante assunzione di alcool (Manzo, 1979; King, 1982). Esperimenti su animali hanno dimostrato che l'alcool favorisce il passaggio dei barbiturici nel cervello e ne rallenta significativamente la rimozione dal tessuto nervoso (Stead & Moffat 1983).
I tessuti poco perfusi (muscoli, tessuto adiposo) fungono spesso da deposito delle sostanze lipofile, le quali vengono concentrate a tale livello per essere poi cedute lentamente nel distretto extracellulare. Il lento equilibrio tra i compartimenti intra- ed extracellulare è all'origine dell'effetto "reservoir" che talora si osserva quando l'eliminazione terapeutica dei tossici viene accelerata con procedure drastiche, quali la emodialisi o la emoperfusione: il trattamento comporta la progressiva diminuzione dei livelli ematici della sostanza i quali, tuttavia, tornano ad innalzarsi allorché il trattamento viene interrotto. Tale situazione è stata spesso riscontrata nella terapia emodialitica dell'intossicazione da sali di litio (Jacobsen et al. 1987).
(c) Metabolismo Il metabolismo dei composti chimici esogeni ha conseguenze che dipendono dalla attività dei metaboliti: ha significato detossicante se i metaboliti sono inattivi o meno attivi della sostanza di origine. Si assiste invece alla comparsa o alla accentuazione della tossicità quando il composto di origine, di per sé poco attivo o inattivo, subisce un processo di attivazione metabolica (Perucca & Manzo, 1988). Questo fenomeno ha rilevanza negli avvelenamenti da paracetamolo, metanolo, glicole etilenico, parathion, glutetimide, e dopo esposizione a solventi alogenati quali tricloroetilene, 1,2-dicloropropano e tetracloruro di carbonio (Hansen et al., 1975; Cheng et al., 1987).
La tossicità per attivazione ha due aspetti caratteristici: (a) la sintomatologia si manifesta con una certa latenza che riflette il tempo necessario perché i metaboliti tossici vengano generati fino a raggiungere concentrazioni critiche nei tessuti bersaglio; (b) mancano di solito correlazioni tra i livelli ematici del farmaco e lo stato del paziente, le cui condizioni possono anzi aggravarsi man mano che diminuiscono i livelli ematici della sostanza assorbita. Il deterioramento funzionale degli organi preposti al metabolismo ha influenze sulla cinetica dei tossici in quanto prolunga la loro permanenza nell'organismo. Particolare importanza ha, nel corso degli avvelenamenti, la depressione dell'attività farmaco-metabolizzante del fegato che può essere causata sia da lesioni parenchimali indotte dal tossico sia da squilibri emodinamici che riducono la perfusione epatica.
L'attivazione farmacologica dei processi di detossicazione epatica è stata oggetto di numerosi studi in prospettiva terapeutica. Il corredo degli enzimi farmaco-metabolizzanti può essere, in effetti, aumentato mediante somministrazione di farmaci induttori, quali il fenobarbitale. Tale procedura, tuttavia, oltre ad essere non priva di effetti secondari, richiede somministrazioni ripetute nell'arco di alcuni giorni, cioè tempi troppo lunghi per essere compatibile con l'intervento d'urgenza nella intossicazione acuta. Esistono induttori meno tossici, quali i flavoni, che agiscono con rapidità in quanto attivano il corredo enzimatico pre-esistente. Non risulta, tuttavia, che tali sostanze siano state oggetto di studio in relazione a possibili impieghi in tossicologia clinica. Il processo opposto, cioè la manipolazione farmacologica intesa ad impedire la generazione di metaboliti tossici è già da tempo in uso nell'uomo. Un noto esempio è l'impiego dell'alcool etilico negli avvelenamenti da metanolo o da glicole etilenico (Peterson et al.,1981).
(d) Eliminazione L'eliminazione ha un ruolo centrale nella tossicocinetica clinica. La terapia di molti avvelenamenti è principalmente diretta a sostenere le funzioni vitali e a proteggere la funzionalità degli organi emuntori onde consentire la eliminazione fisiologica del tossico. Nelle intossicazioni più gravi trovano talora impiego, compatibilmente con le caratteristiche cinetiche del veleno, procedure specifiche intese ad accelerare la rimozione della sostanza o dei suoi metaboliti dall'organismo (Pond et al., 1979; Pond, 1986).
Il calcolo della emivita plasmatica rende talora possibile la stima approssimativa dei tempi necessari perché i livelli ematici della sostanza scendano nel paziente a valori sub-tossici. Tuttavia, come già ricordato, molte sostanze presentano ad alte dosi cinetiche di eliminazione non lineari a causa della saturazione del metabolismo e/o della escrezione (Tabella I). In questi casi, il calcolo della emivita non ha alcun valore pratico se non si dispone di dati certi sulla dose totale assorbita. Sul ruolo della diuresi forzata e delle procedure extrarenali (emodialisi, emoperfusione) in tossicologia clinica sono stati condotti numerosi studi (Tilston et al., 1979; Rosenbaum et al., 1980; Henry et al., 1981; Cherskov, 1982).
Le biomembrane sono più permeabili alle sostanze non ionizzate che a quelle ionizzate. Pertanto, per le sostanze eliminate dal rene, il riassorbimento nei tubuli diminuisce quanto più il composto si presenta ionizzato nell'urina tubulare. Dato che il grado di ionizzazione degli acidi deboli aumenta se questi si trovano in ambiente alcalino e quello delle sostanze basiche aumenta nelle soluzioni acide, è possibile incrementare l'escrezione renale dei tossici acidi o basici attraverso procedure che determinano opportune variazioni del pH e del flusso urinario (Ambre, 1983).
L'ingestione di tossici in quantità potenzialmente letali, la presenza di sintomi gravi, il riscontro di livelli ematici straordinariamente elevati, la evidenza che i processi di eliminazione sono saturati, la comparsa di deficit delle vie escretrici, il progressivo deterioramento dello stato del paziente nonostante la terapia intensiva sono tutte condizioni che, in linea di principio, suggeriscono il ricorso alle misure drastiche di eliminazione terapeutica, quali l'emodialisi e l'emoperfusione. Tuttavia, è spesso difficile prevedere quali pazienti potranno trarre effettivi benefici di queste procedure anche in relazione al loro intrinseco potenziale di morbidità (Todd, 1984; Henry et al., 1984).
In ogni caso, il ricorso alla depurazione extracorporea è concettualmente giustificato solo per le sostanze che hanno caratteristiche farmacocinetiche compatibili. Per i tossici con spiccata tendenza alla diffusione nei tessuti, forte affinità per le proteine plasmatiche e ampio volume di distribuzione, è poco probabile che l'aumento della clearance determinato dalla emodialisi o dalla emoperfusione si associ a risultati clinicamente significativi, data la modesta frazione della dose che si trova in forma libera nel circolo.
L'eliminazione extra-corporea può invece risultare vantaggiosa negli avvelenamenti gravi da sostanze quali teofillina, paracetamolo, tricloroetanolo, cloralio idrato, e certi barbiturici che, ad alte dosi, presentano una cinetica di eliminazione non lineare. Per queste sostanze, quanto più alti sono i livelli ematici tanto meno efficiente sarà la loro clearance endogena e perciò più consistenti dovrebbero essere i benefici della dialisi e dell'emoperfusione (Rosenberg et al, 1981; Heath e Knudsen, 1987).
Nelle iniziali esperienze sulla depurazione extracorporea applicata alla tossicologia clinica, l'efficacia delle singole tecniche è stata valutata quasi esclusivamente sulla base del giudizio clinico, senza alcun reperto analitico che desse supporto alle conclusioni tratte del ricercatore. In tempi più recenti, gli effetti della dialisi e della emoperfusione sono stati spesso valutati con criteri farmacocinetici (Tilston et al., 1979; Wellhoner, 1983). Purtroppo, nei lavori su questo tema si trovano spesso due tipi di errori che complicano la lettura dei risultati. Gli effetti vengono valutati tenendo conto delle variazioni della emivita plasmatica piuttosto che in base alla quantità totale di tossico estratta dal plasma in un certo periodo di tempo. Tale criterio è inadeguato in quanto tende ad ignorare sia la caduta dei livelli plasmatici assoluti che caratterizza la fase di distribuzione, sia l'aumento "rebound" delle concentrazioni plasmatiche che, al termine del trattamento, riflette il richiamo della sostanza dai depositi tessutali. Imprecise sono anche le valutazioni basate sul confronto tra le quantità complessive di tossico eliminate in presenza o in assenza del trattamento extracorporeo, dato che la dose presente nell'organismo allorché il trattamento viene istituito risulta quasi sempre sconosciuta (Tilston et al., 1979).
Avvelenamenti da formulazioni farmaceutiche a lento rilascio
L'impiego in medicina di preparati a lento rilascio è sempre più diffuso. L'ingestione di dosi tossiche comporta speciali problemi date le peculiari caratteristiche cinetiche dei principi attivi di queste formulazioni. L'assorbimento è di solito più lento e prolungato, e il picco di concentrazione viene raggiunto non prima di 24-36 ore. La tossicità si manifesta dopo un periodo di latenza più o meno lungo e le manifestazioni regrediscono piuttosto lentamente al termine della fase acuta a causa dell'assorbimento protratto della sostanza nel lume intestinale. Esempi di farmaci utilizzati in formulazioni orali a lento rilascio sono la teofillina, la proclorperazina, la fenilpropanolamina, il litio e gli antiaritmici procainamide e disopiramide. Nella terapia dell'avvelenamento hanno importanza la somministrazione ripetuta di carbone e l'irrigazione intestinale, da istituirsi possibilmente già nella fase pre-sintomatica, al fine di limitare la quantità di principio attivo che passa in circolo (Minocha e Spyker, 1986).
L'analisi tossicocinetica quantitativa costituisce una guida per affrontare con criteri scientifici i problemi diagnostici e terapeutici della tossicologia clinica. Attraverso modelli matematici è possibile caratterizzare nel singolo paziente sia il tipo di distribuzione che i movimenti del tossico fino a poter correlare, in certi casi, il profilo farmacocinetico con l'evoluzione dei sintomi ed il decorso clinico. L'andamento delle concentrazioni del veleno fornisce inoltre indicazioni utili per la scelta e il controllo della terapia nel paziente intossicato.
Il laboratorio chimico-tossicologico, avvalendosi di apparecchiature e tecniche analitiche sempre più sensibili, precise e selettive, potrà trovare nella tossicocinetica gli spunti per allargare il proprio campo d'azione dalla fase diagnostica allo studio di aspetti quantitativi e temporali degli avvelenamenti la cui conoscenza è importante per un intervento clinico razionale.
Nella pratica corrente, solo di rado l'analisi chimico-tossicologica viene effettuata attraverso indagini seriate che comprendano, ove necessario, l'identificazione e il dosaggio dei metaboliti attivi. Una ulteriore limitazione viene dal fatto che solo per pochi composti si conoscono al momento attuale le caratteristiche farmacocinetiche in situazioni di sovradosaggio. Anche per i farmaci più noti, i dati della letteratura sono spesso di difficile interpretazione. La dose o il momento della esposizione al tossico sono molte volte imprecisati; in altri casi, i prelievi per le analisi tossicologiche risultano essere stati effettuati per tempi troppo brevi o, ancora, manca l'adeguata valutazione di patologie pre-esistenti o di altri fattori capaci di modificare la farmacocinetica (Rosenberg et al., 1981).
Sarebbe auspicabile che, integrando competenze cliniche, farmaco-tossicologiche ed analitiche, le osservazioni farmacocinetiche venissero approfondite ed estese al maggior numero di sostanze che sono causa di avvelenamenti nell'uomo.
Tabella I. Esempi di sostanze che presentano cinetiche di saturazione*
| Salicilici | Prednisolone |
| Paracetamolo | Diossano |
| Teofillina | Alcool etilico |
| Fenitoina | Acido triclorofenossiacetico (2,4,5 T) |
| Chinidina | Cloruro di vinile |
| Amilobarbitone | Cloralio idrato |
| Sulfametazina | Tricloroetanolo |
* Rif.: Mullen, 1980; Rosenberg et al., 1981.
Tabella II. Adsorbimento dei tossici da parte del carbone attivato "in vitro" *
| elevato | moderato | Scarso | |
| Amfetamine | Aspirina | Cianuri | |
| Antidepressivi | Benzene | Etanolo | |
| Antiepilettici | Bifenili policlorurati | Ferro | |
| Antistaminici | Cherosene | Glicole etilenico | |
| Atropina | Clorpropamide | Litio | |
| Barbiturici | Dicloroetano | Metanolo | |
| Benzodiazepine | DDT | Sostanze caustiche | |
| Chinidina | Disopiramide | ||
| Chinina | Fenolo | ||
| Cimetidina | Malathion | ||
| Fenotiazine | Mexiletina | ||
| Fenilbutazone | Paracetamolo | ||
| Fenilpropanolamina | Tolazamide | ||
| Furosemide | Tolbutamide | ||
| Glibenclamide | Glipizide | ||
| Glucosidi digitalici | Indometacina | ||
| Oppiacei | |||
| Piroxicam | |||
| Stricnina | |||
| Teofillina | |||
* modificato da Neuvonen e Olkkola, 1988.
Ambre I.: Principles of pharmacology for the clinician. In: Clinical Management of Poisoning and Drug Overdose, Haddad L. M.,Winchester. F. (eds),Saunders. Philade!phia. 1983; 18-41.
Benowitz N. L., Rosenberg J., Becker C. E.: CardiopuIrnonary catastrophcs in drug-overdosed patients. Med Clin North Am 1979; 63:267-296.
Benowitz N. L., Meister D. \V.: Pharmacokinetics in patients with cardiac faiIure. Clin Pharmacokin 1976; 1:389-405.
Blaschke T. E.: Protein hinding and kinctics of drugs in Iivcr discasc. Clin Pharmacokin 1:7 2:32-44.
Brown T. C. K.: The use of sodium bicarbonate in the treatment of tricyclic antidepressant induced arrhythmias. Anaesth Intens Care 1973; 1:203-210.
Cheng J. T., Beysolow T. D., KauI B., Weisman R., Feinfeld D. A.: Clearance of ethylene glycol by kidneys and hemodialysis. Clin Toxicol 1987; 25:95-105.
Cherskov M.: Extracorporeal detoxification: still debatable. J Am Med Ass 1982; 247:3047-3048.
Dawling S., Chand S., Braithwaite R. A., Crome P.: In vitro and in vivo evaluation of two preparations of activated charcoal as adsorbents of aspirin. Human Toxicol 1983; 2:211-216.
Dyson E. H., Simpson D., Prcscott L. F., Proudfoot A. T.: Self-poisoning and therapeutic intoxication with lithium. Human Toxicol 1987; 6:325-329.
Feely J., Brodie M. J.: Pratical clinical pharrnacology: drug handling and response. Br Med J 1988; 296:1046-1050.
Hansen A. R., Kennedy K. A., Arnbre J. J.: Glutethiinide poisoning: a metabolite contributes to morbidity and mortality. N Engl J Med 1975; 292:25~252.
Heath A., Knudsen K., Role of extracorporeal removal in acute theophylline poisoning. Med Toxicol 1987; 2:294-308.
Henry J. A., Volans G. N., Widdop B.: Do measures to enhance drug removai save life? Lancet 1984; 1:561.
Jacobsen D., Aasen G., Frederichsen P., Eisenga B.: Lithium intoxication: pharmacokinetics during and after terminated hemodialysis in acute intoxications. Clin Toxicol 1987; 25:81-94.
King L. A.: Effects of ethanol on drug levels in blood in fatal cases. Med Sci Law 1982; 22:232- 237.
Levy G.: Gastrointestinal clearance of drugs with activated charcoal. N Eng J Med 1982; 307:676-678.
Manzo L.: Interferenze tra alcool e medicamenti. In: Nuovi Aspetti di Tossicologia Sperimentale e Clinica, Bertelli A. (ed.), Edizioni Medico Scientifiche, Torino, 1979; 545-567.
McAllister R. O., Tan T. O., Todd E. P.: Effect of hypothermia on the metabolism of propranolo!, quinidine and verapamil. Clin Pharrnac Ther 1978; 23:121-130.
Minocha A., Spyker D. A.: Acute overdose with sustained release drug formulation. Perspectives in treatment. Med Toxicol 1986; 1:300-307.
Mullen P. W.: Pharmacokinetic considerations in toxicology. In: Advances in Neurotoxicology, Manzo L. (ed.) Pergamon Press, Oxford-New York 1980; 287-306.
Neuvonen P. J.: Clinica! pharmacokinetics of oral activated charcoal in acute intoxications. Clin Pharmacokin 1982; 7:465-489.
Neuvonen P. J., Olkkola K. T.: Ora! activated charcoal in the treatment of intoxications. Role of singie and repeated doses. Med Toxico! 1988; 3:33-58.
Perucca E., Manzo L.: Metabolic activation of neurotoxicants. In: Recent Advances in Nervous System Toxicology, Galli C. L., Manzo L. Spencer P. 5., Pie num, New York, 1988, in stampa.
Peterson C. D., Col!ins A. J., Himes J. Nt.. BuI!ock Nt. L., Keane W. F.: Ethylene glycol poisoning. Pharrnacokinetics during therapy with ethanol and hcmodia!ysis. New Engl J Med 1981;304:21-23.
Pond S. M.: Role of repeated oral doses of acivated charcoal in clinical toxicology. Med Toxicol 1986; 1:3-11.
Pond S. M., Olson K. R., Osterloh J. D.. Tong T. G.: Randomized study of the treatment o! phenobarbital overdose with repeated doses of activated charcoal. J Am Med Ass 1984; 251:3104-3108.
Pond S., Rosenberg J., Benowitz N. L. Takki S: Pharrnacokinctics of haemoperfusion for drug overdose. Clin Pharmacokin 1979; 4:329-354.
Reidenberg M. M.: Kidney funclion and drug action. N Engl J Med 1985; 313:816-818.
Rosenbaum J. L., Kramer M. 5., Raja R. Nt.: Current status of hernoperfusion in toxicology. Clin Toxicol 1980; 17:493-500.
Rosenherg J., Benowitz N. L., Pond S.: Pharmacokinetics of drug overdose. Clin Pharrnacokin 1981; 6:161-192.
Shannon Nt., Fish S. S, Lovejov F. H. Jr.: Cathartics and !axatives do they still have a pIace in management of the poisoned patient? Med Toxicol 1986: 1:247-252
Stead A. H., Moffat A. C.: Quantification of the interaction between barhiturates and alcohol and interpretation of fatal blood concentrations. Human Toxicol 1983; 2:5-14.
Tilston W. J., Winchester J. F., Reavey P. C.: The use of pharmacokinetic principles in determining the effectiveness of removal of toxins from blood. C!in Pharmacokin 1979; 4:23-27.
Todd J. W.: Do rneasures to enhance drug removat save life? Lancet 1984; 1:331.
Traeger S. M., Haug III M. T.: Reduetion of diazeparn serurn half life and reversal of corna by activated charcoal in a patient with severe liver disease. Clin Toxicol 1986; 24:329-337
Wanke L. A.: Toxicokinetics. In: Toxicologic Emergencies, Bayer M. J., Rurnack B. H., Wanke L A. (eds.), Brady Co.Publ., Bowie, MD, 1984, 19-35.
Wellhoner H. H.: Calculation of pharrnacokinetic pararneters from hetnodialysis or hemoperfusion data. A rnathematical treatise. Arch Toxicol 1983; 53:17-31.
Wilkinson G. R., Clearance approaches in pharrnacology. Pharmacol Rev 1987; 39:1-47.