______________________________________________________
3 L'USO DEGLI ANTIBIOTICI IN
TERAPIA INTENSIVA
_______________________________________________________
Claudio Santini
III° Clinica Medica -
Dipartimento di Medicina Clinica - Università "La
Sapienza"- Roma
e-mail: Tarasi_md@tin.it
INTRODUZIONE
Sebbene i letti nelle unità di
terapia intensiva (UTI) non superino il 5% dei letti disponibili
in ospedale ed i pazienti ricoverati in UTI non siano più del
10% di tutti i pazienti ricoverati, le infezioni acquisite in
questi reparti rappresentano oltre il 20% delle infezioni
nosocomiali. La diagnosi di infezione nei pazienti in UTI non è
sempre facile: spesso il sospetto clinico di un processo
infettivo in atto è alimentato dalla presenza di febbre, ma la
febbre può mancare in corso di infezioni in pazienti defedati, o
in pazienti in trattamento con antiinfiammatori, così come può
essere provocata da cause non infettive (recente intervento
chirurgico, traumi cranici, atelettasie, flebiti correlate a
cateteri endovascolari, riassorbimento di ematomi, uso di
farmaci).
Le infezioni che più
frequentemente si verificano nelle UTI sono le polmoniti (40-45%
di tutte le infezioni), seguite dalle sepsi da CVC (12-17%),
dalle sepsi primitive (12-15%), dalle infezioni delle vie
urinarie (10-12%) e dalle infezioni gastro-enteriche (10-12%). La
mortalità per infezioni in UTI supera il 40% (1). La gravità
delle infezioni che occorrono nelle UTI è certamente dovuta alla
compromissione dello stato generale dei pazienti e al frequente
coinvolgimento di materiale protesico (tubi endotracheali, linee
venose centrali, cateteri urinari), ma è anche dovuta alla
frequente etiologia da microrganismi antibiotico-resistenti.
Nelle terapie intensive, dove gli
antibiotici vengono impiegati più diffusamente e più a lungo
che in qualsiasi altro reparto, la sopravvivenza dei principali
microrganismi patogeni è consentita principalmente attraverso la
selezione di ceppi antibiotico-resistenti. La stretta e costante
vicinanza degli ammalati, inoltre, facilita la trasmissione di
questi microrganismi da paziente a paziente. Non è un caso che i
principali responsabili di infezione in UTI siano Staphylococcus
aureus ed epidermidis, Pseudomonas aeruginosa, Enterococcus
e Candida, tutti caratterizzati dall'essere frequentemente
multiantibiotico-resistenti. In pazienti precedentemente trattati
con antibiotici emergono inoltre come responsabili di
superinfezioni patogeni opportunisti come Acinetobacter, Stenotrophomonas
maltophilia, Enterobacter, tutti altamente resistenti
agli antibiotici. Il fenomeno dell'antibiotico-resistenza si è
diffuso progressivamente e già alla fine degli anni ottanta
aveva raggiunto proporzioni allarmanti: negli Stati Uniti erano
resistenti il 24% dei ceppi di Enterobacter cloacae alle
cefalosporine di terza generazione, il 12% dei ceppi di Pseudomonas
aeruginosa agli aminoglicosidi, il 17% dei ceppi di Staphylococcus
aureus all'oxacillina e il 20% dei ceppi di Enterococcus
alla gentamicina (2).
Il precedente impiego di
antibiotici modifica profondamente il tipo di infezioni che
possono svilupparsi, la loro etiologia e la loro prognosi. I
bacilli enterici Gram negativi, ad esempio, sono responsabili del
20% delle polmoniti in pazienti non precedentemente trattati con
antibiotici, ma del 69% delle polmoniti in pazienti in terapia
antibiotica; l'incidenza di Pseudomonas aeruginosa, passa
dal 5% al 40% (3); la mortalità sale dal 54.2% al 71.4% (4).
Tra i microrganismi Gram negativi
il più frequente meccanismo di antibiotico-resistenza è
rappresentato dalla produzione di betalattamasi, sia cromosomiche
che plasmidiche. La produzione di betalattamasi è spesso indotta
dall'uso di antibiotici quali il ceftazidime o l'imipenem e
comporta lo sviluppo di resistenze in corso di trattamento. Di
particolare importanza è la selezione di Enterobacter
resistente alla cefalosporine di terza generazione, che si
verifica nel 20% dei casi; il trattamento di queste infezioni
richiede l'uso di imipenem, di ureido-penicilline o di
cefalosporine di quarta generazione quali il cefepime. L'uso
indiscriminato di imipenem-cilastatin, soprattutto se in
monoterapia, espone invece al rischio di selezione di ceppi
resistenti di Pseudomonas aeruginosa, di Acinetobacter,
di Pseudomonas cepacia e di Stenotrophomonas
maltophilia.
Anche le polmoniti da cocchi Gram
positivi risentono profondamente del precedente uso degli
antibiotici: in una serie di 49 polmoniti da Staphylococcus
aureus associate a ventilatore, 38 furono dovute a ceppi
oxacillina-sensibili e 11 a ceppi oxacillina-resistenti; la
percentuale dei pazienti precedentemente trattati con antibiotici
era del 21% e del 100% rispettivamente (5). Le polmoniti dovute a
ceppi oxacillina-resistenti furono gravate da una mortalità
maggiore (55% verso 3%) e da una maggiore frequenza di
batteriemia (36% verso 11%) e di shock (27% verso 9%).
Il problema
dell'oxacillina-resistenza è di particolare importanza in
Italia: in uno studio multicentrico effettuato in Europa e che ha
coinvolto 40 ospedali di dieci diversi nazioni, l'Italia è
risultata il paese con la maggiore incidenza di Staphylococcus
aureus oxacillina-resistente (34.4%); assai inferiore è
risultata la percentuale di ceppi resistenti in Svizzera (1.8%),
Olanda (1.5%), Svezia (0.3%) e Danimarca (0.1%) (6). Nelle
terapie intensive romane, in particolare, è
oxacillina-resistente l'80% dei ceppi di Staphylococcus aureus
(7). I ceppi oxacillina-resistenti sono resistenti anche a molti
altri antibiotici generalmente efficaci sugli Stafilococchi
oxacillina-sensibili, con l'unica costante eccezione
rappresentata dai glicopeptidi, vancomicina e teicoplanina (8).
Negli anni novanta si è assistito al fenomeno inquietante di una
progressiva riduzione della attività in vitro nei confronti di Staphylococcus
aureus anche di questi glicopeptidi: fino al 1992 nessun
ceppo di Staphylococcus aureus isolato nel nostro
Policlinico aveva MIC di teicoplanina >4 mg/l; il 10% dei
ceppi isolati nel periodo 1993-94 aveva invece MIC di 4 mg/l; il
fenomeno ha invece coinvolto molto meno la vancomicina (9).
Agli inizi degli anni novanta è
emerso un nuovo problema, rappresentato dalla resistenza di Enterococcus
alla vancomicina: il primo ceppo di Enterococcus
vancomicina-resistente fu isolato nel 1988; attualmente
l'incidenza di tali microrganismi è superiore al 20% in molti
ospedali degli Stati Uniti; ancora più preoccupante è la
dimostrazione che la caratteristica della vancomicina-resistenza
può essere trasmessa da Enterococcus a Staphylococcus
mediante plasmidi, lasciando prospettare la possibilità di
infezioni gravi, da microrganismi altamente virulenti, e
potenzialmente intrattabili.
La facilità con cui è possibile
indurre la selezione di microrganismi antibiotico-resistenti deve
suggerire un uso più razionale degli antibiotici.
| LINEE GUIDA
ALL'USO DEGLI ANTIBIOTICI IN UTI |
L'uso degli antibiotici in UTI
può essere suggerito da tre possibili ragioni: terapia empirica
di infezioni documentate clinicamente, terapia mirata di
infezioni documentate microbiologicamente, profilassi di
infezioni probabili a verificarsi.
Mentre la scelta degli antibiotici
da usare nel trattamento mirato si basa sulla conoscenza del
patogeno responsabile dell'infezione e della sua sensibilità
agli antibiotici, nell'instaurare un trattamento empirico ci si
baserà sulle conoscenze dei probabili patogeni, legate a
informazioni epidemiologiche del singolo centro. Data la gravità
delle condizioni generali della maggior parte dei pazienti e
l'elevata mortalità per infezione, anche quando sia stato
possibile effettuare le colture microbiologiche, è spesso
necessario iniziare una terapia antibiotica empirica
immediatamente, prima di conoscere il patogeno causale; il
trattamento empirico verrà poi modificato in base alla
sensibilità antibiotica dei microrganismi isolati. L'uso degli
antibiotici in profilassi va invece limitato alla prevenzione
dell'infezione di ferita chirurgica nelle prime 24-48 ore dopo
l'intervento; in particolare va scoraggiata la profilassi
antibiotica sistemica delle polmoniti associate a ventilatore e
delle sepsi da catetere.
| TERAPIA EMPIRICA DELLE POLMONITI
ASSOCIATE A VENTILATORE |
Tra tutte le infezioni che si
verificano nelle UTI, le polmoniti sono le più frequenti, le
più gravi ed anche le più difficili da diagnosticare: gli
elementi diagnostici tradizionali (febbre, espettorazione
purulenta e comparsa di infiltrato all'Rx del torace) sono
difficili da valutare e la loro sensibilità e specificità sono
piuttosto basse (64% e 80% rispettivamente) (10).
Anche gli esami microbiologici
sono difficili da valutare, poichè i più probabili patogeni
sono anche i più frequenti contaminanti. E' necessario ricorrere
a colture quantitative di materiale raccolto con metodiche
standard, quali il brushing protetto (sensibilità del 77% e
specificità del 92%) o il lavaggio bronchiolo-alveolare
(sensibilità del 57% e specificità del 91%). Gli esami
microbiologici quantitativi, tuttavia, forniscono indicazioni
solo 24-48 ore dopo la loro esecuzione e non soddisfano la
necessità di instaurare subito una terapia antibiotica efficace.
Come guida alla scelta degli antibiotici da usare empiricamente
è stato proposto l'esame diretto del materiale ottenuto dal
brushing protetto, previa ultracentrifugazione con cytospin: tale
metodica ha dimostrato una sensibilità dell'85% e una
specificità del 94% in confronto alle colture quantitative e
può pertanto essere utilizzata nella scelta del trattamento
empirico (11).
Una guida alla scelta degli
antibiotici da usare empiricamente viene anche dal tempo di
insorgenza della polmonite dopo il ricovero del paziente: le
polmoniti che insorgono nei primi tre giorni di ricovero sono
definite precoci (early onset pneumonia) e sono dovute
principalmente a Streptococcus pneumoniae, Haemophilus
influenzae, Moraxella catarrhalis e Staphylococcus
aureus oxacillina sensibile (12): si tratta di germi presenti
nel cavo orale del paziente al momento del ricovero e trasferiti
nelle vie respiratorie inferiori con l'intubazione. In tabella 1
sono riportati gli antibiotici attivi su questi microrganismi:
l'associazione di una penicillina ad ampio spettro, come
l'ampicillina o la piperacillina, con un inibitore delle
betalattamasi, come il sulbactam o il tazobactam, è efficace
sulla maggior parte dei microrganismi; una alternativa può
essere rappresentata della cefalosporine di seconda generazione,
quali cefamandolo e cefuroxime, che si sono dimostrate attive
anche su alcuni ceppi di Staphylococcus aureus
oxacillina-resistente.
| Tabella 1 |
TRATTAMENTO
EMPIRICO DELLA POLMONITE ASSOCIATA A VENTILATORE A
INSORGENZA PRECOCE |
| Patogeno
sospettato |
Antibiotico |
Commento |
| Streptococcus
pneumoniae |
Penicillina Ampicillina
Eritromicina
|
Non raccomandati i
chinoloni e le cefalosporine di 3° gen. (tranne
ceftriaxone) |
| Haemophilus influenzae |
Ampicillina-sulbactam Cefalospor. 2-3° gen
|
15-30% produttore di
beta-lattamasi e resistente alla ampicillina |
| Moraxella catarrhalis |
Ampicillina-sulbactam Cefalospor. 2°-3° gen.
Eritrocina
Cotrimoxazolo
Chinoloni
|
50-70% produttore di
beta- lattamasi e resistente alla ampicillina |
| Staphylococcus aureus |
Oxacillina Ampicillina-sulbactam
Cefalospor. 1°-2° gen.
|
90% oxacillina-sensibili |
La polmonite tardiva (late
onset pneumonia, ad insorgenza oltre tre giorni dopo il
ricovero), ha una etiologia ed una patogenesi diverse: è infatti
dovuta a patogeni acquisiti in ospedale e pertanto
antibiotico-resistenti; l'intestino è la sede di origine di
questi microrganismi e le premesse alla polmonite sono la
colonizzazione gastrica, favorita dall'uso di antiacidi e di H2
inibitori, e quindi la colonizzazione del tubo endotracheale; una
colonizzazione da bacilli Gram negativi dell'orofaringe si
verifica nel 45% dei pazienti entro una settimana di intubazione
e un quarto di essi sviluppa polmonite (13). In tabella 2 è
riportato il peso relativo di diversi fattori di rischio in
pazienti intubati: la reintubazione, la aspirazione gastrica e la
tracheostomia sono gli eventi che più incrementano il rischio di
sviluppare polmonite (14). I bacilli Gram negativi di origine
enterica (Klebsiella ed Enterobacter spp. in
particolare) sono responsabili del 30-50% di queste polmoniti; Pseudomonas
aeruginosa si riscontra nel 15-20% dei casi, Haemphilus
influenzae nel 10-15%; tra i cocchi Gram positivi predominano
gli Stafilococchi (10-25% dei casi), mentre l'incidenza di Enterococcus
non supera il 2-3%. Gli antibiotici attivi per le diverse
etiologie sono riportati in tabella 3: la necessità di fornire
una copertura ad ampio spettro fino alla individuazione del
patogeno causale, consiglia di eseguire una terapia empirica di
associazione tra un betalattamico ad attività anti-Pseudomonas
(ceftazidime, piperacillina o imipenem) ed un aminoglicoside
(gentamicina, tobramicina o amikacina). La potenziale presenza di
bacilli Gram negativi antibiotico-resistenti sconsiglia nel
trattamento empirico l'uso di cefalosporine di prima o seconda
generazione e dell'ampicillina, anche se associata ad un
inibitore delle betalattamasi. In conseguenza dell'elevata
incidenza di oxacillina-resistenza tra i ceppi di Staphylococcus
aureus di origine nosocomiale, la vancomicina va associata al
trattamento anti-Gram negativi nelle UTI in cui la etiologia
stafilococcica ha un'incidenza rilevante.
| Tabella
2 --> FATTORI DI RISCHIO DI POLMONITE IN PAZIENTI
INTUBATI |
| fattore
di rischio |
Oddi-ratio |
| malattia di base
rapidamente letale |
2.07 |
| alcolismo (>80 g/die) |
1.93 |
| broncopneumopatia cronica
ostruttiva |
1.92 |
| aspirazione gastrica |
5.33 |
| intubazione per causa non
chirurgica |
2.47 |
| coma |
2.45 |
| tracheostomia |
3.05 |
| pressioni positive (PEEP) |
1.96 |
| reintubazione |
7.40 |
| durata dell'intubazione
>3 giorni |
1.94 |
| (Torres A, Am Rev Resp Dis, 1990) |
| Tabella 3 |
TRATTAMENTO
EMPIRICO DELLA POLMONITE ASSOCIATA A VENTILATORE A
INSORGENZA TARDIVA |
| Patogeno
sospettato |
Antibiotico |
| Escherichia coli, Klebsiella pneumoniae
o altre
|
Cefalospor. 3gen.+
Aminoglicoside |
| Enterobacteriaceae |
Ureidopenicilline +
Aminoglicoside Imipenem
Chinoloni
Piperacillina + Tazobactam
|
| Pseudomonas aeruginosa |
Ceftazidime +
Aminoglicoside Ureidopenicilline
+ Aminoglicoside
Ureidopenicilline +
Ciprofloxacina
Ciprofloxacina +
Aminoglicoside
Imipenem + Aminoglicoside
|
| Staphylococcus aureus |
Vancomicina |
| TERAPIA MIRATA DELLE POLMONITI
ASSOCIATE A VENTILATORE |
Una volta isolato il microrganismo
patogeno è possibile modificare il trattamento instaurato
empiricamente in base ad alcune considerazioni specifiche:
1) una monoterapia con antibiotici
betalattamici è probabilmente adeguate per infezioni causate da
bacilli Gram negativi di origine enterica (Escherichia coli,
Klebsiella pneumoniae, Proteus species) sensibili
"in vitro"; i vantaggi della monoterapia sono una
minore tossicità e minori costi.
2) per le infezioni da Enterobacter
è consigliabile l'uso di imipenem in luogo delle cefalosporine
di terza generazione, data l'elevata incidenza (20%) di selezione
di resistenze in corso di trattamento.
3) per le infezioni da Pseudomonas
aeruginosa è sempre sconsigliabile una monoterapia; il
ceftazidime o la piperacillina, quando attivi, vanno preferiti
all'imipenem, che più facilmente seleziona ceppi resistenti.
4) in considerazione del suo costo
elevato, della possibilità di convulsioni in pazienti con
compromissione del sistema nervoso centrale, della possibile
selezione di ceppi di Pseudomonas aeruginosa resistenti e
di superinfezioni da ceppi multi-antibiotico resistenti, quali Stenotrophomonas
maltophilia, Pseudomonas cepacia e Acinetobacter,
l'uso di Imipenem dovrebbe essere riservato alle polmoniti più
gravi, o a quelle in cui si sospetti una resistenza alla
cefalosporine di terza generazione.
5) l'Aztreonam può rappresentare
una valida alternativa agli aminoglicosidi per i pazienti con
polmoniti da Gram negativi e ridotta funzionalità renale; può
anche sostituire gli antibiotici betalattamici nei pazienti con
ipersensibilità a questi antibiotici, data l'assenza di reazioni
allergiche crociate.
6) i nuovi fluorochinoloni, in
particolare ciprofloxacina, si sono dimostrati efficaci quanto le
cefalosporine di terza generazione e quanto Imipenem nel
trattamento delle polmoniti nosocomiali da bacilli Gram negativi;
in considerazione della frequente selezione di ceppi resistenti
di Pseudomonas aeruginosa e di Staphylococcus aureus,
tuttavia, è da evitare il loro impiego in monoterapia nelle
infezioni dovute a questi microrganismi.
 |
| PROFILASSI DELLA POLMONITE ASSOCIATA A VENTILATORE
|
In tabella
4 sono riportate le misure di profilassi della polmonite
nel paziente intubato (15). Il trattamento aggressivo
della malattia di base è di primaria importanza. Una
accurata valutazione dello stato di nutrizione del
paziente può consentire di evitare una nutrizione
parenterale non necessaria, che comporta un aumento del
rischio infettivo.
|
La precoce ripresa
dell'alimentazione enterale si associa a vantaggi (mantenimento
dell'integrità della mucosa gastro-intestinale, mantenimento
della normale peristalsi con prevenzione della risalita dei germi
nelle vie respiratorie), ma anche a svantaggi (distensione
gastrica con aumento del rischio di reflusso di cibo e
conseguente aspirazione). L'impiego del sondino naso-gastrico
consente di mantenere la normale secrezione di succo gastrico,
evita la distensione dello stomaco e consente una adeguata
nutrizione; l'alimentazione continua attraverso pompe enterali è
da preferirsi all'alimentazione ad intervalli. Il decubito
semiseduto (ad almeno 30°) e l'aspirazione di succo gastrico
residuo sono pure efficaci nel ridurre il rischio di aspirazione.
La conservazione della normale acidità gastrica, impiegando il
sucralfato piuttosto che gli antiacidi o gli H2 inibitori, si è
anche rivelata efficace nel ridurre il rischio di polmonite (16).
| Tabella 4 MISURE DI PREVENZIONE DELLA
POLMONITE ASSOCIATA A VENTILATORE |
GENERALI:
trattamento aggressivo
della malattia di base
evitare H2 inibitori ed
antiacidi
decubito elevato a più di
30°
programmi di nutrizione
enterale e parenterale
precoce estubazione e
rimozione della sonda naso-gastrica
limitazione all'uso degli
antibiotici
|
MANUTENZIONE
DEI SUPPORTI VENTILATORI:
appropriata
sterilizzazione
non trasferire le
apparecchiature da un paziente all'altro
evitare l'inalazione dei
liquidi di condensa
cambio di tubi ed
umidificatori non più spesso che ogni 48 ore
|
CONTROLLO
DELLE INFEZIONI:
sorveglianza
microbiologica
attuazione di programmi di
controllo delle infezioni
lavaggio delle mani da
parte del personale
corrette tecniche di
aspirazione delle secrezioni respiratorie
decontaminazione
intestinale selettiva con antibiotici
|
L'impiego degli antibiotici per
via sistemica rappresenta un fattore di rischio: modifica
l'etiologia della polmonite, aumentando l'incidenza dei bacilli
Gram negativi, aumenta la frequenza di infezioni da ceppi
antibiotico resistenti, in particolare Pseudomonas aeruginosa,
Staphylococcus aureus oxacillina-resistente, Acinetobacter,
Stenotrophomonas maltophilia e Pseudomonas cepacia.
Da quanto detto una profilassi con antibiotici per via sistemica
non solo non è efficace, ma comporta molti rilevanti svantaggi.
L'unico possibile impiego degli antibiotici nella profilassi
della polmonite nei pazienti intubati è quello che si effettua
nella decontaminazione intestinale selettiva: lo scopo di tale
decontaminazione è quello di ridurre il rischio di
colonizzazione gastrica e oro-faringea da parte dei bacilli Gram
negativi aerobi di origine enterica, preservando la flora
anaerobica che raramente determina polmonite; si impiegano
antibiotici non assorbibili, somministrati attraverso il sondino
naso-gastrico. Sono state utilizzate associazioni di neomicina,
polimixina e vancomicina (o amfotericina) per un periodo
variabile da tre giorni a più di un mese. Si è ottenuta una
riduzione della colonizzazione tracheo-bronchiale e del numero di
polmoniti da bacilli Gram negativi e da Staphylococcus aureus
nelle prime due settimane rispetto ai pazienti non trattati (17),
tuttavia non è ancora chiara l'utilità di questa pratica per
periodi più prolungati, soprattutto alla luce della possibile
selezione di ceppi resistenti.
| TERAPIA DELLE INFEZIONI URINARIE |
| Quasi tutti i pazienti
ricoverati in UTI sono portatori di catetere vescicale.
Quando le misure di prevenzione delle infezioni urinarie
(posizionamento in asepsi, sistema di drenaggio chiuso,
ancoraggio al meato uretrale esterno per evitare
fluttuazioni in vescica, acidificazione delle urine)
falliscono, l'infezione urinaria può manifestarsi con
febbre e leucocitosi, accompagnate da urine torbide; la
presenza di leucocituria conferma la diagnosi;
l'urinocoltura rappresenta l'indagine che consente di
individuare il patogeno responsabile e la sua
sensibilità antibiotica. Le Enterobacteriaceae, in
particolare Escherichia coli, Klebsiella species,
Proteus species ed Enterobacter species
sono i microrganismi più frequentemente isolati;
l'incidenza di infezioni da Pseudomonas aeruginosa,
Enterococcus e Candida species aumenta nei
pazienti sotto terapia antibiotica. Le prove di
sensibilità antibiotica "in vitro" sono molto
importanti nella scelta della terapia: in genere sono
necessarie le cefalosporine di terza generazione o i
fluorochinoloni. |
 |
| TERAPIA DELLE SEPSI DA CATETERE
ENDOVASCOLARE |
 |
La contaminazione
batterica di un catetere endovascolare inizia in genere a
partire della sede d'inserzione; i microrganismi migrano
quindi lungo il catetere fino a contaminare il trombo che
invariabilmente è depositato sulla porzione del catetere
che penetra nel vaso; i microrganismi trovano in questo
trombo un pabulum favorevole; vi si insediano,
proliferano e penetrano in circolo. La tromboflebite
settica assume una particolare importanza se il patogeno
è Staphylococcus aureus e spiega la possibile
persistenza della batteriemia dopo rimozione del
catetere. |
| In tabella 5
sono riportati i microrganismi responsabili di sepsi da
catetere endovascolare e di tromboflebite settica in 159
pazienti ricoverati in UTI (18): Staphylococcus aureus
è responsabile della metà delle sepsi e dei due terzi
delle tromboflebiti; un ulteriore 20% delle sepsi è
dovuto a Staphylococcus epidermidis. La batteriemia da Staphylococcus
aureus impone la rimozione della linea venosa e una
terapia antibiotica ; si impiegherà l'oxacillina o una
cefalosporina di seconda generazione (cefamandolo e
cefuroxime) se il microrganismo è oxacillina-sensibile,
oppure la vancomicina se è oxacillina- resistente. Due
settimane di terapia sono probabilmente sufficienti in
caso di precoce miglioramento clinico, ma se la febbre
persiste per più di 3 giorni dopo la rimozione della
linea e l'inizio della terapia è più prudente
effettuare antibiotici per 4 settimane, dato il rischio
della comparsa di focolai settici a distanza (endocarditi
o osteomieliti in particolare).
Se la batteriemia è
causata da Staphylococcus epidermidis e non c'è
evidenza di infiltrazione dei tessuti nella sede
d'inserzione, è possibile tentare una terapia
antibiotica senza rimuovere il catetere; data la
antibiotico-resistenza di questo microrganismo dovrà
essere impiegata la vancomicina; in caso di recidiva
della batteriemia, tuttavia, si impongono la rimozione
del catetere e l'effettuazione di una ecocardiografia
allo scopo di valutare la presenza di una endocardite
della valvola tricuspide.
|
| Tabella 5 |
| MICRORGANISMI
RESPONSABILI DI INFEZIONI DI CVC E DI TROMBOFLEBITI IN
UTI |
| microrganismo |
CVC |
tromboflebite |
| Staphylococcus aureus |
78 |
23 |
| Staphylococcus
epidermidis |
33 |
3 |
| Serratia species |
18 |
2 |
| Klebsiella species |
11 |
4 |
| Candida species |
11 |
2 |
| Enterococcus
species |
8 |
1 |
| Proteus species |
6 |
2 |
| Enterobacter
species |
5 |
0 |
| altri |
6 |
1 |
| Totale |
176 |
38 |
| (Fry DE, Infect.Dis.Clin.Pract., 1996 |
BIBLIOGRAFIA
1) Abramson NS, Adverse
occurrences in intensive care units. JAMA, 244:1582, 1980
2) Schaberg D, Am.J.Med., 3B:72S,
1991
3) Rello J, Quintana E, Ausina V,
Incidence, etiology and outcome of nosocomial pneumonia in
mechanically ventilated patients. Chest, 100:439, 1991
4) Fagon JY, Chastre J, Hance AJ,
Montravers P, Novara A, Gilbert C, Nosocomial pneumonia in
ventilated patients: a cohort study evaluating attributable
mortality and hospital stay. Am.J.Med., 94:281, 1993
5) Rello J, Torres A, Ricert A,
Valles J, Gonzales J, Artigas A, Ventilator-associated pneumonia
by Staphylococcus aureus. Comparison of methicillin-resistant and
methicillin-sensitive episodes. Am.J.Resp.Crit.Care Med.,
150:1545, 1994
6) Voss A, Milatovic D,
Wallranch-Schwarz C, Rosdahl VT, Braveny J, Methicillin-resistant
Staphylococcus aureus in Europe.
Eur.J.Clin.Microbiol.Infect.Dis., 13:50, 1994
7) Baiocchi P, Capone A, De Rosa
R, Penni A, Santini C, Venditti M, Surveillance study on
Staphylococcus aureus in Rome: preliminary data on the frequency
of oxacillin resistance among nosocomial and community isolates,
Microecology and Therapy, 25: 373, 1995
8) Venditti M, Baiocchi P,
Brandimarte C, Capone A, Fimiani C, Santini C, Tarasi A, High
rate of oxacillin-resistant Staphylococcus aureus isolates in an
Italian University Hospital. J.Chemother., 6:25, 1994
9) Baiocchi P, Capone A, Carfagna
P, Santini C, Venditti M, Changes in susceptibilities to
teicoplanin, vancomycin and other antibiotics among
Staphylococcus aureus isolates in a tertiary-care University
Hospital. Int. J. Antimicrob. Ag., 7:93, 1996
10) Andrews CP, Coalson JJ, Smith
JD, Johanson WG Jr, Diagnosis of nosocomial bacterial pneumonia
in acute, diffuse lung injury. Chest, 80:254, 1981
11) Marquette CH, Wallet F,
Neviere R, Copin MC, Saulnier F, Drault JN, Mehdaoui H, Mathieu
D, Ramon P, Diagnostic value of direct examination of the
protected specimen brush in ventilator-associated pneumonia.
Eur.Respir.J., 7:105, 1994
12) Stoutenbeek CP, Van Seane JFK,
Miranda DR, Zandstra DF, Langreher D, The effect of oropharyngeal
decontamination usin topical nonadsorbable antibiotics on the
incidence of nosocomial respiratory tract infections in multiple
trauma patients. J.Trauma, 27:357, 1987
13) Johanson WG Jr, Pierce AK,
Sanford JP, Thomas GD, Nosocomial respiratory infections with
Gram negative bacilli: the significance of colonization of the
respiratory tract. Ann.Int.Med., 77:701, 1972
14) Torres A, Aznar R, Gatell JM,
Jimenez P, Gonzalez J, Ferrer A, Celis R, Rodriguez-Roisin R,
Incidence, risk and prognosis factors of nosocomial pneumonia in
mechanically ventilated patients. Am.Rev.Resp.Dis., 142:523, 1990
15) Craven DE, Steger KA,
Nosocomial pneumonia in the intubated patient: new concepts on
pathogenesis and prevention. Infect.Dis.North Am., 3:843,1989
16) Tryba M, Risk of acute
bleeding and nosocomial pneumonia in ventilated intensive care
unit patients: sucralfate versus antiacids. Am.J.Med., 83 (suppl.
3B):117, 1987
17) Pugin J, Auckenthaler R, Lew
DP, Suter PM, Oropharyngeal decontamination decreases incidence
of ventilator-associated pneumonia. JAMA, 265:2704, 1991
18) Fry DE, Special consideration
in the critically ill patient. Infect.Dis.Clin.Pract., 5:S20,
1996
______________________________________________________
4 MANUALI DI ANESTESIA:
Chirurgia addominale - Resezione del tenue
______________________________________________________
Questa rubrica, curata dal dott. Lelio
Guglielmo, presenta i
protocolli anestesiologici adottati ,nelle varie specialità
chirurgiche , dal Servizio di Anestesia e Rianimazione dell'
Ospedale Buccheri La Ferla. Questi manuali che sono il frutto di
studi e dell'esperienza di oltre 15 anni di attività
anestesiologica non pretendono ovviamente di avere un carattere
"universale" . E' evidente altresì che l'applicazione
delle procedure descritte va valutata criticamente in relazione
al proprio ambiente di lavoro. La parte riguardante le
considerazioni chirurgiche è stata realizzata in collaborazione
con i chirurghi delle varie specialità, operanti nel nostro
ospedale.
Qualsiasi commento o critica è
bene accetta e può essere inviata a leliobuc@tin.it oppure alla redazione LANZA@MBOX.UNIPA.IT
| Anestesia in chirurgia
addominale RESEZIONE
DEL TENUE
|
 |
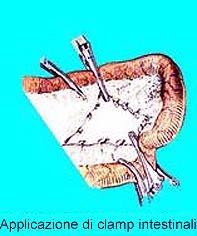
| Considerazioni
chirurgiche La resezione
del piccolo intestino viene eseguita per numerosi
tipi di malattie.Dopo essere penetrati nella cavità
peritoneale, il segmento interessato viene esposto e
sezionato tra due pinze intestinali. Una quantità
variabile di mesentere,dipendente dal tipo di patologia,
viene inclusa nella resezione. Resezioni più estese
comprendenti i linfonodi regionali sono indicate per
patologie neoplastiche di tipo maligno. L' anastomosi
può essere effettuata attraverso diverse tecniche di
sutura o con punti metallici. La cavità peritoneale può
essere raggiunta attraverso un' incisione verticale
oppure trasversale. Le tecniche operatorie prevedono la
formazione di anastomosi termino-terminali aperte o
chiuse, oppure latero-laterali eseguite con punti di
sutura o con lo stapler.
La diagnosi preoperatoria usuale è
rappresentata da una ostruzione intestinale complicata da
necrosi intestinale, invaginazioni, occlusione vascolare
mesenterica, m.di Crohn, enterite da radiazione, fistole
intestinali, tumori del piccolo intestino e traumi. Rari
sono i tumori primitivi ileali ,ma spesso un'ansa
intestinale aderisce ai tumori del colon e deve essere
resecata.
|
 |
 |
| CARATTERISTICHE
DELLA POPOLAZIONE DI PAZIENTI Range di età : 20-70. Maschio:
femmina 1 :1.
Eziologia :
ischemia a.mesenterica (volvolo, trombosi,etc.),M.di
Crohn
Condizione
associate : dipendenti dalla causa
|
SOMMARIO DELLE PROCEDURE
| POSIZIONE |
Supina |
| INCISIONE |
Addominale mediana |
| ANTIBIOTICI |
Ceftriaxone-Tobramicina |
| TEMPO CHIRURGICO |
2-4 h |
| PERDITE EMATICHE |
0-500 ml |
| POSTOPERATORIO |
reparto |
| MORTALITA' |
0-5% |
| MORBILITA' |
compl.polmonari : <10% infezione ferita :
<5%
ileo intestinale : <10%
fistola : <3%
|
| PAIN SCORE |
6-8 |
| Considerazioni
anestesiologiche per interventi sul tenue (laparotomia
esplorativa, resezione ileale, enterolisi, chiusura di
fistole enteriche,exeresi di tumori intraddominali).
PREOPERATORIO
I pazienti che richiedono
una laparotomia esplorativa sono spesso a rischio di
aspirazione di contenuto gastrico. Quindi sono necessarie
precauzioni per prevenire questo evento.
App.
respiratorio: La
patologia addominale può determinare insufficienza
respiratoria a causa di: diminuzione della capacità
funzionale residua, aumento del gradiente alveolo
arterioso, risalita del diaframma. I pazienti con
patologie polmonari croniche possono andare incontro ad
un peggioramento severo delle condizioni cliniche.Tests:
Rx torace; EGAApp. cardiovascolare: Il paziente può presentare i
segni di una ipovolemia con ipotensione e tachicardia e
deve ricevere un riempimento vascolare adeguato prima
dell'induzione dell'anestesia.App.muscoloscheletrico: l'addome può essere rigido e
molto dolente.App. gastrointestinale: Diarrea, vomito,e uno stato di
digiuno prolungato possono determinare delle anomalie
elettrolitiche.App.urinario: soprattutto nei pazienti anziani ed in
quelli ipovolemici può essere presente uno stato
iniziale di insufficienza renale .Premedicazione della
veglia: Tavor 10-20 gtt. la sera e la mattina
dell'intervento solo in pazienti di età > a 70a.
|
INTRAOPERATORIO
| EMODILUIZIONE |
come da protocollo |
| PREMEDICAZIONE |
standard. Dobutamina come da
protocollo |
| TECNICA ANESTESIOLOGICA |
AG + AP o AG . Il cateterino verrà
posizionato a livello di T10-T11 e verrà iniettato un
bolo di 8-10 ml di Lido. 1% o Bupi. 0.25%. In urgenza si
può posizionare il cateterino peridurale ed utilizzarlo
per l'analgesia peridurale solo nel post-operatorio |
| INDUZIONE |
standard con propofol . Valutare
attentamente la volemia del paziente. In caso di
ipovolemia
(ipotensione,tachicardia,emoconcentrazione,etc.)
infondere rapidamente 500ml di Emagel prima
dell'induzione. |
| MANTENIMENTO |
nel caso di AG infusione continua
di propofol e remifentanil. Nel caso di AG+AP infusione
peridurale continua di Marc.0.3% a 6mlh + propofol. |
| RICHIESTA DI SANGUE |
Prevedere perdite ematiche.
Richiedere almeno 2U. di emazie concentrate. |
| ACCESSI VENOSI |
2 cateteri 16 G + v.centrale (
catetere lungo dalla v.basilica, v.giugulare interna
,v.succlavia) |
| MONITORAGGIO |
standard + Pa cruenta, Coe (doppler
esofageo). Valutare caso per caso l'opportunità di
inserire Swan-Ganz |
| RISVEGLIO |
generalmente in S.O. Il pz.
verrà invece mantenuto in VAM (in Sala Risveglio) se le
sue condizioni emodinamiche e respiratorie saranno
instabili. |
| COMPLICANZE |
emorragia ,sepsi |
POSTOPERATORIO
| COMPLICANZE |
emorragia -ipotermia- Insuff.respiratoria
(atelettasie,polmonite)
|
| ANALGESIA
POST-OPERATORIA |
Infusione peridurale continua con Marc.0.3%
a 6 mlh ; Meperidina IM 50 mg/6h e Diclofenac
75 mg /8h |
-----------------------------------------------------------------------------------------
Informazioni sulla rivista
EDUCATIONAL SYNOPSES IN
ANESTHESIOLOGY
and
CRITICAL CARE MEDICINE-Italia-
Educational Synopses in Anesthesia
and Critical Care Medicine-Italia costituisce la parte Italiana
della versione Americana, pubblicata su Internet da Keith J
Ruskin, Professore di Anestesia alla Università di Yale. I
lavori saranno accettati sia in lingua Italiana che Inglese. In
quelli di lingua Italiana un corposo riassunto in Inglese verrà
preparato dalla redazione, qualora l'autore non fosse in grado di
fornirlo. A cura della redazione sarà inoltre la traduzione in
Italiano dei manoscritti inviati in lingua Inglese. La rivista
sarà inviata gratuitamente a tutti quelli che ne faranno
richiesta inviando il seguente messaggio "Desidero ricevere
ESIA versione italiana" indirizzato a LANZA@MBOX.UNIPA.IT
La rivista pubblica rewiews e
lavori originali compiuti nei campi dell'anestesia e della
medicina critica. I lavori originali riguardano ricerche
cliniche, di laboratorio e la presentazione di casi clinici. Le
reviews includono argomenti per l'Educazione Medica Continua
(EMC), articoli di revisione generale o riguardanti le
attrezzature tecniche. ESIA pubblicale lettere all'Editore
contenenti commenti su articoli precedentemente publicati ed
anche brevi comunicazioni. La guida per gli autori può essere
consultata collegandosi al sito ANESTIT all'indirizzo:
http://www.unipa.it/~lanza
utilizzando la sezione riservata
ad ESIA-Italia
Oppure può essere richiesta
inviando un messaggio a
lanza@mbox.unipa.it
EDUCATIONAL SYNOPSES IN
ANESTHESIOLOGY
and
CRITICAL CARE MEDICINE Sezione
Italiana
E' anche ottenibile attraverso
World-WideWeb WWW: L' URL per questo numero di ESIA è:
http://www.unipa.it/~lanza/esiait/esit9803.txt
Il nome della rivista è
esitaamm, dove aa è l'anno ed mm
il mese
(per esempio questo numero è
esit9803.txt)
LA REDAZIONE DI ESIA ITALIA
DIRETTORE
Vincenzo LANZA
Primario del Servizio d'Anestesia
e Rianimazione Ospedale Buccheri La Ferla Fatebenefratelli
Palermo LANZA@MBOX.UNIPA.IT
Terapia Intensiva
Antonio Braschi
Primario del Servizio d'Anestesia
e Rianimazione 1
Policlinico S. Matteo - IRCCS
Pavia
Anestesia Cadiovascolare
Riccardo Campodonico
Responsabile dell'Unità di
Terapia Intensiva Cardiochirurgica
Azienda Ospedaliera di Parma ricrob@mbox.vol.it
Anestesia e malattie epatiche
Andrea De Gasperi
Gruppo trapianti epatici / CCM
Ospedale Niguarda - Milano
Medicina critica e
dell'emergenza
Antonio Gullo
Professore di Terapia Intensiva
Direttore del Dipartimento di
Anestesia e Terapia Intensiva-Università di Trieste
Anestesia ed informatica
Vincenzo Lanza
Primario del Servizio d'Anestesia
e Rianimazione Ospedale Buccheri La Ferla Fatebenefratelli
Palermo
Tossicologia
Carlo Locatelli
Direttore del Centro di
Informazione Tossicologica Centro antiveleni di Pavia
Fondazione Scientifica
"Salvatore Maugeri Clinica
delLavoro e della Riabilitazione"
Pavia
Terapia Antalgica e Cure
Palliative
Sebastiano Mercadante
Aiuto del Servizio d'Anestesia e
Rianimazione
Ospedale Buccheri La Ferla
Fatebenefratelli
Palermo





