RIDUZIONE E FISSAZIONE INTERNA DI FRATTURE PROSSIMALI DEL FEMORE
___________________________________________________________________
2 Valutazione dell'efficacia
dell'emoperfusione nell'avvelenamento da Paraquat. Caso clinico
___________________________________________________________________
Zoppellari R *, Brunaldi V **, Righini
F **, Mantovani *, Avato FM **, Zatelli R *.
* 1° Servizio di Anestesia e Rianimazione, Azienda Ospedaliera Arcispedale S. Anna, Ferrara.
** Istituto di Medicina Legale e delle
Assicurazioni, Università degli Studi di Ferrara, Ferrara.
Autore cui fare riferimento: Dott. Roberto Zoppellari, 1°
Servizio di Anestesia e Rianimazione, Azienda Ospedaliera Arcispedale
S. Anna, Corso Giovecca 203, 44100 Ferrara ( tel 0532 206299 -
fax 0532 295588 ).
RIASSUNTO
In un avvelenamento mortale da paraquat è stata valutata
l'efficacia di due trattamenti emoperfusivi di 3 ore iniziati
a 8.5 e 17 ore dall'ingestione. Le due emoperfusioni hanno rimosso
solo lo 0.24% della dose ingerita (42 mg/kg). Durante il primo
trattamento emoperfusivo, il paraquat eliminato con la diuresi
forzata (6.78 mg) è stato maggiore di quello rimosso con
l'emoperfusione (3.598 mg). I dati cinetici di questo caso mostrano
una elevata distribuzione tissutale del paraquat: i volumi distributivi
del compartimento centrale ed allo steady state sono rispettivamente
11.8 e 142 l/kg. Perciò l'emoperfusione è una tecnica
di efficacia trascurabile, mentre una precoce diuresi forzata
è più utile.
ABSTRACT
In a case of lethal paraquat poisoning the efficacy of haemoperfusion
was studied. We evaluated two haemoperfusions lasted 3 hours and
started at 8.5 and 17 hours after ingestion. Haemoperfusion treatments
removed only 0.24 % of ingested dose (42 mg/kg). During the first
haemoperfusion, the amount eliminated through forced diuresis
(6.78 mg) was higher than through the extracorporeal technique
(3.598 mg). Kinetic data of this case showed high paraquat distribution
to tissues: distribution volumes of central compartment and at
steady state were respectively 11.8 and 142 l/kg. So haemoperfusion
is an ineffective epuration technique, whereas early forced diuresis
might be useful.
PAROLE CHIAVE
Paraquat, emoperfusione, diuresi forzata, avvelenamento, tossicocinetica.
INTRODUZIONE
Il paraquat è un erbicida dipiridilico la cui assunzione
è spesso mortale. La maggior parte delle persone che ingeriscono
dosi di paraquat comprese fra 20-40 mg/kg decedono per insufficienza
respiratoria entro 2 o 3 settimane, mentre per più di 50
mg/kg il decesso avviene in pochi giorni per insufficienza multiorganica
(1). La tossicità del paraquat non è ancora completamente
spiegata (2). A livello cellulare il paraquat (PQ++)
è sottoposto dalla nicotinamide adenin dinucleotide fosfato
(NADPH) a riduzione elettronica, che porta alla nascita di radicale
paraquat (PQ+) e NADP+. In presenza di ossigeno,
questa reazione è immediatamente seguita dalla ossidazione
del radicale paraquat a paraquat, con formazione di anione superossido
(O2 -). Il ciclo ossidoriduttivo continua
fino a che è presente ossigeno, portando alla deplezione
di NADPH. L'ossigeno singoletto ed i radicali liberi che conseguono
all'anione superossido inducono perossidazione lipidica delle
membrane cellulari (2) (3).L'erbicida si accumula soprattutto
a livello polmonare (4), dove produce un quadro di adult respiratory
distress syndrome (ARDS) per distruzione delle cellule dell'epitelio
alveolare (3). Il trattamento del paziente intossicato da paraquat
è basato su misure indirizzate a modificare sia la cinetica
che la dinamica del tossico (3). La tossicocinetica può
essere modificata riducendone l'assorbimento (5), rimuovendolo
dal plasma (6), inibendone la penetrazione nelle cellule dell'epitelio
alveolare (7) e bloccandolo con anticorpi (8). Le misure applicate
per intervenire sul meccanismo d'azione dell'erbicida sono deputate:
a prevenire la perossidazione lipidica somministrando superossidodismutasi
(9), chelanti del ferro (10), vitamine C ed E (11), N-Acetilcisteina
(12), miscele con bassa percentuale di ossigeno (13); a ridurre
l'insorgenza della fibrosi polmonare con corticosteroidi e immunosoppressivi
(14) o irradiando il polmone (15); a migliorare gli scambi gassosi
erogando ossido nitrico (16). Purtroppo i benefici clinici dei
trattamenti proposti nell'avvelenamento da paraquat sono stati
trascurabili (17). In particolare, per quanto riguarda l'emoperfusione,
applicata per rimuovere l'erbicida dal plasma, mancano dati certi
sull'efficacia e sul beneficio clinico della metodica (18): solo
uno studio (19) ha attribuito all'emoperfusione l'outcome favorevole
di 6 gravi intossicati con paraquat. In una revisione critica
su 42 pazienti (20), l'applicazione della metodica non ha prevenuto
il decesso; in una casistica recente di 40 intossicati (21), i
soggetti sottoposti ad un trattamento emoperfusivo protratto per
oltre 10 ore avrebbero presentato un prolungamento della degenza
in terapia intensiva, in assenza però di modificazione
dell'esito infausto, rispetto a quelli trattati per tempi minori.
In questo studio viene presentato un caso di avvelenamento da
paraquat in cui è stata valutata l'efficacia dell'emoperfusione
in rapporto alla dose ingerita, all'eliminazione con la diuresi
forzata e alle caratteristiche tossicocinetiche dell'erbicida.
CASO CLINICO
Un soggetto di sesso maschile di 21 anni e 61 kg di peso, ingerisce
intenzionalmente circa 22 ml di un liquido commerciale contenente
paraquat all'11.7% e diquat al 5.9%. Successivamente il soggetto
viene accompagnato dai familiari in ospedale e ricoverato dopo
circa 3 ore dall'ingestione in rianimazione. Il paziente è
cosciente, orientato e senza segni di insufficienza respiratoria;
lamenta faringodinia e nausea. L'obbiettività rivela un
marcato edema dell'orofaringe, come da contatto con sostanza caustica.
Dopo una fase iniziale di reticenza, il soggetto riferisce il
gesto autolesionista, mentre viene recuperato dai familiari il
prodotto incriminato.
Previo posizionamento di sondino nasogastrico si esegue una abbondante gastrolusi e si somministra sospensione-soluzione di terra di Fuller al 30 % e solfato di magnesio al 5% (22). Nelle successive 48 ore la sospensione viene somministrata alla dose di 4 ml/kg ogni 4 ore. Dopo l'esecuzione di un test rapido urinario, con kit al sodioditionito, che risulta debolmente positivo per presenza di paraquat, viene eseguita in laboratorio tossicologico la conferma qualitativa dell'erbicida nel sangue e la sua determinazione quantitativa, dato che la concentrazione ematica viene utilizzata per la stima della probabilità di sopravvivenza (23). Sulla base del livello riscontrato, si decide di ricorrere all'emoperfusione per rimuovere il paraquat. L'allestimento del sistema extracorporeo è rallentato dal paziente, che, pur sedato per il rifiuto delle cure, si strappa i cateteri. Il paziente viene comunque sottoposto a due emoperfusioni, di tre ore ciascuna, iniziate a 8.5 e 17 ore dall'ingestione. Nei primi 3 giorni sono infusi liquidi in modo da mantenere una diuresi forzata di circa 100 ml/kg/giorno. Il trattamento del paziente è completato dal'infusione di N-acetilcisteina e dalla somministrazione di vitamine C , E e di metilprednisolone. Un progressivo quadro di ARDS compromette la funzione respiratoria: a circa 80 ore dall'ingestione il paziente viene intubato e sottoposto a ventilazione meccanica con inalazione di basse frazioni di ossigeno, ma sufficienti a garantire la saturazione arteriosa dell'emoglobina maggiore del 90%. Viene anche posizionato un catetere di Swan-Ganz per monitorare la funzione cardiorespiratoria e modulare la terapia. Tramite ripetute esofagogastroscopie si monitorizza l'evoluzione delle lesioni erosive del primo tratto del tubo digerente. Alla insufficienza respiratoria, refrattaria alla terapia, si associa la comparsa di insufficienza cardiovascolare, renale ed epatica ed il soggetto decede a 14 giorni dal gesto autolesionista.
METODI
La determinazione nei campioni biologici degli erbicidi dipiridilici,
paraquat e diquat, è stata eseguita mediante Cromatografia
Liquida ad Alte Prestazioni (HPLC) e rivelazione nell'ultravioletto
(24). Per l'analisi si è ricorsi al sistema HPLC della
ditta Merck Hitachi, costituito da una pompa L 6200, rivelatore
UV/VIS L 4200, iniettore Rheodyne 7125 e integratore D 2500. L'estrazione
e la ripartizione cromatografica in fase inversa degli erbicidi
sono state realizzate con il sodio dodecilsolfato come accoppiante
ionico (24). Il sistema extracorporeo utilizzato è costituito
da catetere in arteria femorale, circuito con pompa peristaltica
per mantenere un flusso di 200 ml / min attraverso la cartuccia
contenente 150 g di carbone rivestito (modello 150 della ditta
Gambro), sistema di eparinizzazione e catetere in vena femorale
per la reinfusione del sangue. Durante le sedute emoperfusive,
i campioni di sangue sono stati prelevati contemporaneamente da
rubinetti inseriti nel circuito extracorporeo, prima e dopo la
cartuccia, ai tempi indicati nella tabella 3. La clearance extracorporea
(Cl) è stata calcolata con la formula (25):
dove Ci e Cu rappresentano rispettivamente
le concentrazioni seriche di paraquat all'ingresso ed all'uscita
della cartuccia, mentre Q è il flusso ematico nel sistema.
La quantità totale estratta con ciascuna emoperfusione
è stata calcolata per integrazione (26). Oltre a dosaggi
seriati di paraquat e, in due campioni, di diquat nel siero, sono
stati dosati i livelli urinari dell'erbicida e sono state eseguite
determinazioni quotidiane della quantità eliminata con
l'urina. Inoltre è stata determinata la quantità
di paraquat eliminata per via urinaria durante ciascuna emoperfusione.
Abbiamo stimato in 22 ml il volume di prodotto commerciale ingerito,
sulla base della conferma ripetuta del paziente dell'assunzione
di tutto il liquido contenibile nel tappo del recipiente incriminato
(il volume contenibile nel tappo è risultato essere circa
23 ml). E' stata anche verificata la concentrazione del paraquat
e del diquat del prodotto commerciale con l'analisi HPLC. Sulla
base di 14 determinazioni seriche eseguite nel corso della degenza,
escludendo i dosaggi eseguiti durante le emoperfusioni, è
stato descritto il decadimento serico del paraquat.
RISULTATI
Le concentrazioni di paraquat e diquat indicate nell'etichetta
commerciale sono state confermate dalle analisi. E' stata stimata
perciò una dose ingerita di 2574 mg di paraquat (42.2 mg/kg)
e di 1298 mg di diquat (21.3 mg/kg). La tabella 1 riporta i livelli
serici di paraquat ai tempi indicati. Il wash out del paraquat
è descritto dal seguente modello a due compartimenti:
| tempo (1 = 24 ore ) | ng/ml | tempo (1 = 24 ore ) | ng/ml |
| .125 | 1711 | 1.333 | 220 |
| .166 | 1541 | 1.531 | 225 |
| .25 | 864 | 2.333 | 181 |
| .354 | 635 | 3.333 | 125 |
| .583 | 132 | 4.333 | 72 |
| .712 | 280 | 8.79 | 81 |
| 1 | 266 | 10.7 | 54 |
La tabella 2 presenta alcune delle determinazioni indicate nella tabella precedente, con i due riscontri di diquat ed i valori soglia di paraquat suggeriti come letali ai tempi indicati (23).
| ore dalla ingestione | paraquat serico
mg / l | diquat serico
mg / l | paraquat plasmatico
mg / l |
| 3 | 1.711 | 0.96 | - |
| 4 | 1.541 | - | 2 |
| 6 | 0.864 | 0.39 | 0.6 |
| 24 | 0.266 | - | 0.1 |
La tabella 3 mostra le concentrazioni di paraquat all'ingresso ed all'uscita della cartuccia, i valori di clearance, la quantità rimossa con l'emoperfusione e quella eliminata con la diuresi forzata durante la procedura extracorporea. Durante il primo trattamento emoperfusivo, la quantità di paraquat eliminata per via renale è stata maggiore di quella rimossa con l'emoperfusione (rapporto diuresi forzata/emoperfusione: 6.78 mg/3.598 mg = 1.88). Nel secondo trattamento lo stesso rapporto è risultato 0.32.
TABELLA 3 : concentrazioni di paraquat all'ingresso (Ci) ed all'uscita (Cu) della cartuccia, valori di clearance (Cl), quantità di paraquat rimossa con ciascuna emoperfusione (HP) ed eliminata con la diuresi forzata durante la seduta emoperfusiva (FD).
| ore dalla
ingestione | Ci
ng/ml | Cu
ng/ml | Cl
ml/min | HP
mg | FD
mg |
| 8.5 | 635 | 320 | 99 | ||
| 9.5 | 450 | 275 | 78 | ||
| 10.5 | 236 | 56 | 153 | ||
| 11.5 | 120 | 44 | 127 | 3.598 | 6.78 |
| 17 | 280 | 147 | 95 | ||
| 17.25 | 245 | 88 | 128 | ||
| 18 | 184 | 100 | 91 | ||
| 19 | 220 | 92 | 116 | ||
| 20 | 160 | 95 | 81 | 2.7 | 0.87 |
La tabella 4 riporta le concentrazioni urinarie determinate durante la degenza, mentre la 5 indica le quantità di paraquat eliminate giornalmente con l'urina. Quest'ultima evidenzia che nelle prime 24 ore è presente nell'urina circa il 53 % del paraquat totale eliminato per via renale nel corso della degenza.
| tempo (1 = 24 ore ) | µg/ml | tempo (1 = 24 ore ) | µg/ml |
| .125 | 17.1 | .83 | 1 |
| .166 | 21.9 | 1.33 | 1.6 |
| .25 | 28.2 | 3.33 | .73 |
| .4 | 22.8 | 4.33 | .83 |
| .46 | 11.1 | 8.83 | .91 |
| .58 | 4.4 | 10.83 | .27 |
| Giorno | mg | Giorno | mg |
| 1° | 33.478 | 8° | 1.470 |
| 2° | 5.237 | 9° | 1.312 |
| 3° | 7.387 | 10° | 2.870 |
| 4° | 2.555 | 11° | 1.750 |
| 5° | 2.241 | 12° | 1.085 |
| 6° | 1.496 | 13° | 0.924 |
| 7° | 1.288 | 14° | 0.399 |
| totale 63.492 mg |
Infine, nella tabella 6, sono indicati
i dati di cinetica del paraquat, che abbiamo calcolato (27) a
partire dalla dose ingerita e dai valori serici riscontrati.
| Dose ingerita | circa 2574 mg |
| Volume di distribuzione del compartimento centrale | 11.8 l / kg |
| Volume di distribuzione allo steady state | 142 l / kg |
| Costante di velocità di eliminazione | 1.91 giorni -1 |
| Costante di velocità dal compartimento centrale al profondo | 3.98 giorni-1 |
| Costante di velocità dal compartimento profondo al centrale | 0.73 giorni -1 |
| Emivita di eliminazione | 5.59 giorni |
| Clearance totale | 22.5 l / kg / giorno |
L'utilizzazione del test diagnostico sull'urina disponibile in kit ha portato a terapie drastiche in pazienti lievemente intossicati ed a misure inadeguate in soggetti con grave avvelenamento (22). Come già descritto (28), il paziente ha presentato una positività debole del test all'ingresso, pur in presenza di un elevato livello serico (circa 1.7 µg/ml) ed urinario (circa 17 µg/ml). Oltre alla determinazione qualitativa dell'agente tossico, solo la sua valutazione quantitativa permette di operare una prudente stima prognostica ed una corretta decisione terapeutica (28).
E' noto il valore prognostico del livello ematico di paraquat (23): le concentrazioni che abbiamo riscontrato sono vicine ai valori soglia indicanti una elevata probabilità di decesso (vedi tabella 2). Inoltre il diquat, la cui tossicità polmonare è comunque minore rispetto al paraquat (29), può avere contribuito ad aumentare gli effetti dannosi, pur in misura non quantificabile. Anche la concentrazione urinaria di paraquat è stata utilizzata per la previsione dell'outcome (30): valori superiori a 10 µg/ml riscontrati entro 24 ore dall'ingestione comportano un'elevata probabilità di esito infausto. Si tratta di valori superati nel caso descritto (vedi tabella 4).
E' stato proposto che l'emoperfusione possa essere considerata, entro 12 ore dall'ingestione di paraquat, pur mancando dati a favore di un reale beneficio clinico, in pazienti con concentrazione plasmatica iniziale minore di 3 µg/ml (20). Sulla base di questa proposta, è stato eseguito il primo trattamento emoperfusivo, che ha abbattuto il livello serico da 635 a 120 ng/ml , nei campioni prelevati prima della cartuccia, rispettivamente all'inizio ed alla fine della metodica (vedi tabella 3). Circa 2 ore e mezza dopo la conclusione di quest'ultima, il livello serico è rimasto sostanzialmente stabile (132 ng/ml al tempo 0.583, cioè dopo 14 ore dall'ingestione, come dalla tabella 1). Tuttavia 3 ore dopo, all'inizio della seconda emoperfusione, la concentrazione è salita a 280 ng/ml. Questo effetto rebound, già segnalato (20) e dovuto al lento passaggio di paraquat dai tessuti al sangue parzialmente depleto di erbicida, giustifica l'esecuzione del secondo trattamento emoperfusivo (6).
L'efficacia dell'emoperfusione va valutata sulla base della quantità di tossico estratto rispetto alla dose ingerita ed a quella presunta assorbita e non sulla variazione delle concentrazioni ematiche (25). Nonostante gli elevati valori di clearance, indici della efficiente capacità estrattiva della cartuccia di carbone (vedi tabella 3), le due emoperfusioni hanno rimosso solo lo 0.24 % della dose ingerita (6.298 mg su 2574 mg assunti). Considerando che il paraquat assorbito dal tratto gastroenterico è circa l'1-5 % (31) o l'1-10 % della dose ingerita (32), per un assorbimento medio del 5 %, circa il 4.89 % della quantità presunta assorbita è stata rimossa dal circolo con la procedura extracorporea. Quindi, per un ridotto assorbimento intestinale, anche una piccola quantità rimossa con l'emoperfusione potrebbe essere significativa.
Il paraquat è eliminato dal rene per filtrazione glomerulare e secrezione tubulare ed è debolmente riassorbito dal tubulo renale (6). Fra le modalità di trattamento tentate per aumentare l'eliminazione renale o la rimozione dal circolo (diuresi forzata, dialisi peritonale, emodialisi, emofiltrazione continua arterovenosa, emoperfusione), l'emoperfusione è considerata la procedura più efficace a rimuovere l'erbicida (32) (33). Tale efficacia è maggiore quanto più precoce ne è l'applicazione (3) (33). I nostri risultati hanno evidenziato una importante eliminazione urinaria durante la prima applicazione emoperfusiva, espressa da un rapporto diuresi forzata/emoperfusione di 1.88. Di conseguenza una immediata diuresi forzata, che mantiene la filtrazione e la secrezione tubulare (32), può essere più utile di una emoperfusione precoce. Nel cane è stato dimostrato che l'emoperfusione riduce la mortalità solo se attuata entro 2 ore dalla somministrazione per via endovenosa del paraquat (33). L'assorbimento intestinale nell'uomo è ridotto, ma rapido, e la concentrazione ematica massima viene raggiunta entro 2-4 ore dall'ingestione (34). Il valore di picco, che abbiamo riscontrato a 3 ore dall'atto suicidiario, conferma il veloce assorbimento (vedi tabella 1). La rimozione dell'erbicida dal sangue andrebbe attuata prima della sua captazione da parte delle cellule polmonari (2), dove la concentrazione di picco è raggiunta alla sesta ora (3). Per questi motivi i pazienti potrebbero trarre beneficio dall'emoperfusione solo entro 4 ore dall'ingestione (35). Tuttavia un trattamento così precoce è difficilmente realizzabile (20), sia perchè i pazienti vengono ricoverati tardivamente, sia perchè l'applicazione della metodica richiede il tempo necessario per l'approntamento del circuito extracorporeo (35). La cinetica del paraquat è stata estrapolata dall'animale all'uomo (31) e solo raramente studiata nei pazienti avvelenati (34) (36) (37). I nostri dati confermano l'elevata distribuzione tissutale, il decadimento biesponenziale e l'eliminazione urinaria prevalente nelle prime 24 ore (31). Gli studi nell'uomo sono incompleti, dato che riportano il valore del volume apparente di distribuzione, circa 1.2-1.6 l/kg (34), e non quello allo steady state e del compartimento centrale, che invece abbiamo calcolato (rispettivamente 11.8 e 142 l/kg). I dati della tabella 6 mostrano anche un elevato rapporto fra la costante di trasferimento dal compartimento centrale al profondo (K 12) e la costante dal profondo al centrale (K 21 ). Tale rapporto K 12 / K 21 influenza negativamente l'efficacia dell'emoperfusione (37), che è in grado di ridurre la concentrazione di paraquat nel compartimento centrale, ma non di modificarla in quello periferico, cioè a livello tissutale, e spiega il ritardato effetto rebound riscontrato nel siero alcune ore dopo la procedura extracorporea. Per un tossico con le caratteristiche cinetiche riscontrate, l'emoperfusione non è indicata dal punto di vista razionale (38). Nel caso di un tossico letale come è il paraquat, si è cercato comunque di aumentarne l'eliminazione, "because a potentially fatal condition stimulates the innate desire of many doctors to do something" (1).
In conclusione la nostra valutazione
ha documentato che: 1) nonostante l'efficiente capacità
estrattiva della cartuccia emoperfusiva, la quantità di
paraquat rimossa è limitata rispetto alla dose assorbita;
2) l'emoperfusione si è rivelata meno efficace della diuresi
forzata nell'eliminare l'erbicida; 3) infine, per le caratteristiche
tossicocinetiche discusse, la rimozione extracorporea non è
indicata. Nell'avvelenamento da paraquat, l'emoperfusione è
perciò una tecnica di efficacia trascurabile, mentre una
precoce diuresi forzata è più utile.
1 Vale A & Volans G. The second european symposium on paraquat poisoning, 27th January 1986, Guy's Hospital, London. Editorial. Human Toxicol 1987; 6: 3-6.
2 Lewis CPL, Nemery B. Pathophysiology and biochemical mechanisms of the pulmonary toxicity of paraquat. In Bismuth C & Hall AH (eds) Paraquat poisoning: mechanisms, prevention, treatment, New York: M Dekker Inc., 1995: 107-40.
3 Bismuth C, Garnier R, Baud FJ, Muszynski J, Keyes C. Paraquat poisoning: an overview of the current status. Drug Safety 1990; 5(4): 243-51.
4 Rose MS, Smith LL, Wyatt I. Evidence for energy-dependent accumulation of paraquat into rat lung. Nature 1974; 252: 314-5.
5 Meredith TJ & Vale A.Treatment of paraquat poisoning in man: methods to prevent absorption. Human Toxicol 1987; 6: 49-55.
6 Bismuth C, Scherrmann JM, Garnier R, Baud FJ, Pontal PG. Elimination of paraquat. Human Toxicol 1987; 6: 63-7
7 Dunbar JR, Deluccia AJ, Acuff RV, Ferslew KE. Prolonged intravenous paraquat infusion in the rat: 1. Failure of coinfused putrescine to attenuate pulmonary paraquat uptake, paraquat-induced biochemical changes, or lung injury. Toxicol Appl Pharmacol 1988; 2: 207-20.
8 Nagao M, Takatori T, Wu B et al. Immunotherapy for the treatment of acute paraquat poisoning. Human Toxicol 1989; 8: 121-3.
9 Bateman DN. Pharmacological treatments of paraquat poisoning. Human Toxicol 1987; 6: 57-62.
10 Van der Wal NA, Smith LL, Van Oirschot JF, Van Asbeck BS. Effect of iron chelators on paraquat toxicity in rats and alveolar type II cells. Am Rev Respir Dis 1992; 145: 180.
11 Harley JB, Grinspan S, Root RK. Paraquat suicide in a young woman: results of therapy directed against the superoxide radical. Yale J Biol Med 1977; 50: 481.
12 Hoffer E, Avidor I, Benjaminov O et al. N-Acetylcysteine delays the infiltration of inflammatory cells into the lungs of paraquat-intoxicated rats. Toxicol Appl Pharmacol 1993; 120: 8.
13 Chollet A, Bismuth C, Pham J et al. Hypo-oxygénation avec hypothermie dans l'intoxication humaine par le paraquat: a propos de 6 cas. Toxicol Eur Res 1983; 5: 71-5.
14 Perriens JH, Benimadho S, Kiauw IL, Wisse J, Chee H. High-dose cyclophosphamide and dexamethasone in paraquat poisoning: a prospective study. Hum Exp Toxicol 1992; 11: 129.
15 Talbot AR, Barnes MR. Radiotherapy for the treatment of pulmonary complications of paraquat poisoning. Human Toxicol 1988; 7: 325-32.
16 Koppel C, Wissmann Ch, Barckow D et al. Inhaled nitric oxide in advanced paraquat intoxication. Clin Toxicol 1994; 32 (2), 205-14.
17 Bismuth C & Hall AH. Preface. In Bismuth C & Hall AH (eds) Paraquat poisoning: mechanisms, prevention, treatment, New York: M Dekker Inc., 1995.
18 Winchester JF. History of paraquat intoxication. In Bismuth & Hall AH (eds) Paraquat poisoning: mechanisms, prevention, treatment, New York: M Dekker Inc., 1995: 1-16.
19 Okonek S, Weilemann LS, Majdandzic J, Setyadharma H, Reinicke HJ. Successful treatment of paraquat poisoning: activated charcoal per os and 'continuous hemoperfusion'. J Toxicol Clin Toxicol 1982; 19: 807-19.
20 Hampson EC & Pond SM. Failure of haemoperfusion and haemodialysis to prevent death in paraquat poisoning. A retrospective review of 42 patients. Med Toxicol Adverse Drug Exp 1988; 3: 64-71.
21 Suzuki K, Takasu N, Okabe T et al. Effect of aggressive haemoperfusion on the clinical course of patients with paraquat poisoning. Hum Exp Toxicol 1993; 12: 323-7
22 Bozza Marrubini M, Ghezzi Laurenzi R, Uccelli P. Dipiridilici: paraquat. 2° ed., Milano: Organizzazione Editoriale Medico Farmaceutica, 1987: 980-7.
23 Proudfoot AT, Stewart MS, Levitt T, Widdop B. Paraquat poisoning: significance of plasma-paraquat concentrations. Lancet 1979; ii: 330-2.
24 Papa P, Baldi ML, Groppi A, Polettini A. Contributo sperimentale all'analisi dell'erbicida paraquat in campioni biologici mediante cromatografia liquida ad alta pressione. Arch Med Leg Ass 1988; 10: 505-16.
25 Jaeger A, Kopferschmitt J, Sauder Ph, Flesch F. Bases fondamentales de la toxicocinétique en réanimation. In Baud F, Réanimation des intoxications aigues, Paris: Masson, 1995:42-48.
26 Mathieu D, Gosselin B, Nolf M et al. Massive digitoxin intoxication: treatment by amberlite XAD 4 resin hemoperfusion. J Toxicol Clin Toxicol 1982-3; 19 (9):931-50.
27 Hull CJ. General principles of pharmacokinetics. In Prys-Roberts C & Hug CC (eds) Pharmacokinetics of anaesthesia, Oxford: Blackwell Scientific Publications, 1984: 1-24.
28 Sato S. Human paraquat toxicology. In Bismuth C & Hall AH (eds) Paraquat poisoning: mechanisms, prevention, treatment, New York: M Dekker Inc., 1995: 267-74.
29 Stevens JT & Summer DD. Erbicides. In Hayes WJ & Laws ER (eds) Handbook of pesticide toxicology, San Diego: Academic Press, Inc., 1991; vol 3: 1317-408.
30 Scherrmann JM, Houzé P, Bismuth C, Bourdon R. Prognostic value of plasma and urine paraquat concentration. Human Toxicol 1987; 6: 91-3.
31 Houze P, Baud FJ, Scherrmann JM. Toxicokinetics of paraquat. In Bismuth C & Hall AH (eds) Paraquat poisoning: mechanisms, prevention, treatment, New York: M Dekker Inc., 1995: 161-93.
32 Bismuth C. Treatment of paraquat poisoning: modification of toxicokinetics. In Bismuth C & Hall AH (eds) Paraquat poisoning: mechanisms, prevention, treatment, New York: M Dekker Inc., 1995: 315-24.
33 Pond SM, Rivory LP, Hamson EC, Roberts MS. Kinetics of toxic doses of paraquat and the effects of haemoperfusion in the dog. Clin Toxicol 1993; 31 (2): 229-46.
34 Houzé P, Baud FJ, Mouy R, Bismuth C, Bourdon R, Scherrmann JM. Toxicokinetics of paraquat in humans. Hum Exp Toxicol 1990; 9: 5-12.
35 Pond SM. Treatment of paraquat poisoning. In Bismuth C & Hall AH (eds) Paraquat poisoning: mechanisms, prevention, treatment, New York: M Dekker Inc., 1995: 325-34.
36 Hawksworth GM, Bennett PN, Davies DS. Kinetics of paraquat elimination in the dog. Toxicol Appl Pharmacol 1981; 57: 139-45.
37 Verpooten GA & De Broe ME. Combined hemoperfusion-hemodialysis in severe poisoning: kinetics of drug extraction. Resuscitation 1984; 11: 275-89.
38 Tirot P & Harry P. Limites de
l'épuration extrarénale en toxicologie aigue.In
Baud F, Réanimation des intoxications aigues, Paris: Masson,
1995: 57-62.
___________________________________________________________________
V. Lanza, A. Pignataro, P. De Michele *C. Locatelli
Servizio di Anestesia e Rianimazione, Ospedale Buccheri La Ferla F.B.F., Palermo
*Cento Nazionale di Informazione
Tossicologico, Centro Antiveleni, Fondazione Maugeri, Pavia
Gli organofosfati (OP) vengono comunemente
utilizzati come pesticidi (insetticidi, erbicidi) ; di grande
uso in agricoltura come fitofarmaci, esistono in commercio in
centinaia di tipi e innumerevoli formulazioni. Largamente impiegati
anche nei prodotti casalinghi, queste sostanze rappresentano un
serio pericolo per manufattori, agricoltori e per la popolazione
generale. Gli organofosfati possiedono una tossicità acuta
importante e le intossicazioni avvengono per ingestione, inalazione,
per assorbimento cutaneo, in seguito ad errori d'uso o alla mancanza
di precauzioni nel loro impiego. A scopo suicida vengono solitamente
ingeriti. Nel caso clinico qui descritto, l'ingestione accidentale
di un estere organofosforico ha costretto un paziente ad un ricovero
prolungato nella nostra terapia intensiva.
Un uomo di anni 57 viene
trasportato dai familiari al P.S. dell'Ospedale Buccheri La Ferla
F.B.F. privo di coscienza. All'esame obiettivo il paziente presenta
un GCS di 8, dispnea, cianosi, scialorrea e sudorazione profusa ;
le pupille sono intensamente miotiche, si rileva bradicardia sinusale
(45 bpm), ipotensione arteriosa (80/50 mmHg) e abbondanti secrezioni
respiratorie. Un amico dell'uomo racconta di avere rifiutato una
bevanda maleodorante offertagli dal paziente che invece aveva
bevuto senza esitazione scambiandolo per vino. Il liquido era
contenuto in una bottiglia senza etichetta. La quantità
ingerita poteva essere stimata tra 50 e 100 ml. Poco tempo dopo
il paziente cominciava a perdere coscienza e ad accusare difficoltà
respiratorie, per cui l'amico dopo aver chiamato i familiari dell'intossicato
lo trasportava in ospedale. I familiari riferiscono un'anamnesi
del paziente positiva per diabete e ipertensione (trattata con
beta-bloccanti). Il medico di guardia del P.S. dopo avere approntato
le prime misure d'urgenza chiama l'anestesista-rianimatore che,
constatate le condizioni respiratorie e neurologiche del paziente,
procede all'intubazione endotracheale, alla ventilazione meccanica
e al ricovero nel reparto di terapia intensiva dello stesso ospedale.
In rianimazione persiste uno
stato di coma 2 (agitazione, assenza di risposta alla stimolo
verbale, risposta finalizzata al dolore), bradicardia sinusale
(50 bpm), scialorrea, broncorrea, sudorazione. Il quadro ipotensivo
è sostituito da ipertensione arteriosa (180/90 mmHg). Viene
proseguita la ventilazione meccanica, incannulata l'arteria radiale
per il monitoraggio della pressione arteriosa cruenta, posizionato
un catetere venoso centrale per la terapia infusionale, e vengono
richiesti oltre agli esami di routine (bioumorali, Rx torace,
ECG, boncoaspirato) le colinesterasi plasmatiche nel sospetto
di una intossicazione da organofosforici. Tale sospetto era suffragato
dalla sintomatologia presentata dal paziente all'arrivo in P.S.,
dall'anamnesi raccolta dal testimone (cattivo odore del liquido,
bottiglia senza etichetta) e dall'odore tipicamente nauseabondo
emanato dal paziente stesso. Si pratica la gastrolusi, si somministra
carbone attivo (30 g) e solfato di Mg (30 g) via SNG ; innumerevoli
boli di atropina (0.5-1 mg e.v.) necessitano per ridurre le secrezioni
polmonari e mantenere la frequenza cardiaca al di sopra di 60
bpm.; il dosaggio delle pseudocolinesterasi (589 U/I v.n. 4000-12000
U/I) rafforza il sospetto clinico e la necessità di instaurare
la terapia antidotica specifica: in aggiunta all'atropina
viene somministrata pralidossima (Contrathion)1 g e.v. in bolo,
poi 2 g ogni 4 ore. Il giorno dopo si assiste ad una parziale
ripresa dello stato di coscienza alternato a fasi di agitazione
e ad un miglioramento delle condizioni respiratorie ; persiste
la bradicardia ( ~ 50 bpm) e si manifestano BESV e BEV. L'ipertensione
è trattata con verapamil e nitoglicerina e.v. Si prosegue
la terapia antidotica. L'analisi chimica della sostanza contenuta
nella bottiglia priva di etichetta rivelava la presenza di parathion,
estere organofosforico con una DL nell'uomo compresa tra 10 e
100 mg. Dopo 72 ore di ventilazione meccanica, i parametri clinici,
emogasanalitici e strumentali consentono l'estubazione del pz.
e l'ossigeno-terapia in maschera ; dopo qualche ora per la
comparsa di sudorazione profusa, di abbondanti secrezioni bronchiali
e di fatica muscolare, si rende necessaria una nuova intubazione
endotracheale. Ipertensione, agitazione, disadattamento al repiratore
impongono la sedazione continua con propofol. In 4a giornata,
la persistenza di bradicardia sinusale, interrotta da frequenti
extrasistoli ventricolari da scappamento, nonostante la somministrazione
di atropina in infusione continua (2 mg/h), induce il posizionamento
di un pace-maker temporaneo via vena succlavia sn. con stabilizzazione
della frequenza cardiaca (ca. 70 bpm). Anche la pralidossima viene
somministrata in infusione continua (500 mg/h). Persiste la miosi
e, anche se meno intense, le secrezioni bronchiali, la scialorrea
e la salivazione. La scarsa risposta pressoria alla nitroglicerina
impone l'uso del nitroprussiato di sodio. In 6a giornata un controllo
radiografico per un peggioramento ossigenativo svela un pneumotorace
sn. Il posizionamento di un tubo di drenaggio pleurico determina
una parziale espansione del polmone offeso ; è necessaria
una successiva mobilizzazione e il riposizionamento del drenaggio
(presenza anche di un versamento sieroematico) per ripristinare
i parametri ossigenativi. In 7a giornata, per la risoluzione della
bradicardia, viene disattivato il PM (estratto il giorno successivo)
e sospesa l'infusione continua di atropina e di pralidossima.
In 8a giornata una nuova montata di secrezioni bronchiali determina
un ennesimo peggioramento dell'ossigenazione. La ventilazione
artificiale viene mantenuta fino alla 14a giornata, epoca in cui
una seconda estubazione dà origine ad un quadro brutale
di edema polmonare che ci costringe ad una reintubazione
d'urgenza e alla ripresa della ventilazione meccanica ad elevata
FiO2 . Nello stesso tempo un episodio di TPSV richiede
la somministrazione di striadyne e propanololo. In 15a giornata
avvenuta la riespansione del polmone, viene rimosso il drenaggio
pleurico. Il miglioramento della paO2 permette di ridurre la FiO2
e di ventilare il paziente in pressione assistita. Il controllo
dell'ipertensione conduce alla riduzione del NPS e all'associazione
di un ace-inibitore e di propanololo. In 18a giornata si sospende
il NPS, e la P.A. si mantiene sotto controllo con l'associazione
di captopril e nifedipina ; viene sospeso il beta-bloccante.
Il reperto ascultatorio (rantoli diffusi) e radiografico del torace
(quadro di edema interstiziale), impone il mantenimento della
ventilazione a pressione positiva. A paziente cosciente, collaborante,
con recuperata forza muscolare (assume la posizione seduta), è
possibile, tuttavia, iniziare lo svezzamento dal respiratore ;
nello stesso tempo il paziente inizia gradualmente l'alimentazione
orale. L'estubazione e l'interruzione della ventilazione meccanica
in 21a giornata è finalmente coronata da successo. In 24a
giornata in presenza di condizioni cliniche generali buone e di
parametri bioumorali nella norma, il paziente viene dimesso guarito
dal reparto di rianimazione.
Gli organofosforici (OP) costituiscono una classe estremamente vasta di composti con proprietà fisico-chimiche differenti tra di loro, tutti accomunati dal medesimo meccanismo d'azione : l'inibizione irreversibile dell'enzima acetilcolinesterasi (AchE). Tale enzima è deputato alla scissione dell'acetilcolina (Ach) in colina e acido acetico. L'acetilcolina agisce come neurotrasmettitore dell'impulso nervoso di tutte le fibre pregangliari del sistema nervoso autonomo, delle fibre postgangliari del sistema parasimpatico e di alcune fibre postgangliari simpatiche. L'acetilcolina, inoltre è il neurotrasmettitore della placca neuromuscolare della muscolatura scheletrica e di alcuni interneuroni del sistema nervoso centrale. L'Ach, una volta liberata nello spazio intersinaptico, si lega ai recettori postsinaptici, promuovendo l'effetto farmacologico, e viene distrutta nell'arco di millisecondi. L'acetilcolinesterasi (AchE) è l'enzima che inattiva l'Ach. Un'inibizione dell'AchE quale quella determinata dagli organofosforici, produce un accumulo di Ach endogena e conseguente iperstimolazione colinergica. Gli organofosforici formano per fosforilazione un complesso con l'enzima (AchE) rendendolo indisponibile per la degradazione dell'Ach ; il processo si svolge in due tappe : nella prima, utilizzando un antidoto è possibile spiazzare l'organofosforico, nella seconda tappa la fosforilazione diventa irreversibile secondo un meccanismo denominato "invecchiamento" dell'enzima. Il ritorno dell'attività funzionale dell'enzima è possibile allora con la sintesi di nuova colinesterasi. Nell'uomo esistono due tipi di colinesterasi :
Il dosaggio ematico delle colinesterasi costituisce l'indagine più importante nella diagnosi e nel monitoraggio dell'esposizione a OP. La riduzione delle colinesterasi è infatti strettamente collegata alla durata e all'intensità dell'esposizione agli OP. Le colinesterasi intraeritrocitarie, possedendo gli stessi siti recettoriali di quelle del SNC coinvolte nelle intossicazioni da OP, rappresentano un indicatore più specifico delle plasmacolinesterasi. Alcuni OP (es.malathion), tuttavia inibiscono più precocemente le PchE delle AchE per cui le prime in questo caso hanno maggiore sensibilità delle seconde. Il recupero ossia la rigenerazione delle PchE avviene prima delle AchE. Le PchE possono essere ridotte nelle patologie epatiche croniche, neoplasie, malnutrizione e in gravidanza.
E' possibile stabilire una relazione tra il livello di colinesterasi misurate e i segni clinici dell'intossicazione acuta (tab. 1)
| % AchE inibiz. | Grado di intossicaz. | Segni clinici | Prognosi |
| 50-60 | Lieve | Astenia, cefalea, nausea, salivazione, lacrimazione, miosi | Convalescenza 1-3 g |
| 60-90 | Moderato | Astenia marcata, disturbi visivi, salivazione abbondante, sudoraz., vomito, diarrea, bradicardia, ipertonia, tremori estremità, miosi, cianosi | Convalescenza in 1-2- sett. |
| 90-100 | Severo | Tremori intensi, convulsioni, cianosi intensa, edema polm., coma | Morte |
Le manifestazioni cliniche che si determinano
variano da un composto ad un altro (le DL50 degli OP
variano da pochi mg a qualche g/Kg corporeo) e sono schematizzate
nella tabella 2 :
| sistema respiratorio | broncospasmo, aumento secrezioni, dispnea, dolore toracico, tosse |
| s. gastrointestinale | anoressia, nausea, vomito, crampi addominali, eruttazione, diarrea, tenesmo |
| gh. sudoripare | aumento della sudorazione |
| gh. lacrimali | aumento della lacrimazione |
| gh. salivari | aumento della salivazione |
| vescica | incontinenza urinaria |
| mm. striati | fatica, debolezza, contrazioni muscolari, fascicolazioni, crampi, debolezza generalizzata comprendente i mm. Respiratori |
| gangli simpatici | pallore, transitorio aumento della pressione arteriosa |
| SNC | vertigini, tensione, ansia, irrequietezza, labilità emotiva, insonnia, incubi, cefalea, tremori, apatia, confusione, atassia, confusione, coma |
| s. cardiocircolatorio | bradicardia, riduzione della gittata cardiaca, arresto cardiaco, paralisi del centro vasomotorio |
| pupille | miosi |
| corpo ciliare | visione offuscata |
Nel caso clinico qui descritto, a parte la non comune dinamica dell'intossicazione, la severità del quadro è stata accentuata dalle patologie preesistenti del paziente (ipertensione, diabete) e, almeno in parte, da complicazioni di natura iatrogena. Pur non essendo nota all'inizio la natura della sostanza tossica in questione, i segni e sintomi presentati dal paziente (broncorrea, broncostenosi, bradicardia, scialorrea, salivazione profusa, lacrimazione) deposero immediatamente per un tossico ad azione vagomimetica ; la possibile appartenenza ad un fitofarmaco venne sospettata dal tipico odore agliaceo dell'alito del paziente alla presentazione al P.S., dall'attività professionale (contadino) dell'uomo e dal tipo e sede (rurale) della sua abitazione. La diagnosi differenziale tra organofosforici e carbamati ambedue responsabili di sindromi colinergiche depose a favore degli OP per i bassissimi valori della PChE, per la gravità della sintomatologia (i carbamati non superano la barriera emato-encefalica e la loro tossicitaà sul SNC è limitata) e per la persistenza (>2-4 ore) del quadro clinico.
La sindrome tipica da intossicazione da OP, caratterizzata da segni muscarinici, nicotinici e sul SNC, è stata sin dall'inizio costellata da un quadro ipertensivo severo che ha richiesto un atteggiamento terapeutico aggressivo (nitroglicerina, nitroprussiato di sodio). L'insufficienza respiratoria in prima istanza determinata dal tossico ha richiesto un'intubazione endotracheale e una ventilazione meccanica prolungata; se la prima estubazione può anche essere avvenuta precocemente, considerato il tipico atteggiamento alterno di remissioni e recidive di questo tipo d'intossicazione, il quadro di edema polmonare immediatamente successivo alla 2a estubazione ha verosimilmente un'eziologia emodinamica. La severità dell'intossicazione responsabile di una bradicardia persistente, poco responsiva alla terapia antidotica con atropina e di battiti ectopici ventricolari e sopraventricolari ci ha indotto a posizionare un PM temporaneo. Questa manovra invasiva ha causato un pneumotorace che ha inevitabilmente ritardato lo svezzamento del paziente dalla ventilazione meccanica. La terapia antidotica specifica (atropina, pralidossima) iniziata precocemente è stata mantenuta per otto giorni, preferendo l'infusione continua ai boli ripetuti per la maggiore comodità di somministrazione e la migliore farmacocinetica ; è noto, infatti l'effetto rebound del livello plasmatico degli OP per rilascio progressivo dal tessuto adiposo e dal sitema gastrointestinale. Il trattamento evacuatore (gastrolusi, catarsi), ma soprattutto l'uso ripetuto di carbone attivo basato sull'adsorbimento del tossico sfruttando il circolo enteroepatico, è stato attuato precocemente e continuato per circa 48 ore. La terapia sintomatica condotta contemporaneamente a quella antidotica ha fatto fronte a complicazioni metaboliche (iperglicemia) e infettive (contaminazione dei cateteri intravascolari). Durante tutto il ricovero è stato scrupolosamente mantenuto un corretto assetto idroelettrolitico e nutrizionale, impiegando la nutrizione parenterale totale e quella enterale rispettivamente dal primo giorno e dal recupero della canalizzazione del paziente.
Gli OP sono dei biofarmaci
responsabili di intossicazioni severe. Quando l'esposizione è
massiva, per qualunque via avvenga, si determinano dei gravi quadri
clinici minacciosi per la vita. La rianimazione e la terapia antidotica
specifica vanno impiegati congiuntamente, così come la
decontaminazione digestiva. Complicazioni legate alla terapia
e alle patologie preesistenti dei pazienti possono contribuire
ad allungare la degenza di tali intossicazioni gravate, in ogni
caso, da elevata morbidità e mortalità.
M.O. Amdur, J. Doull, C.D. Klaassen. Tossicologia. EMSI, Ed. Italiana 1993. Effetti tossici dei pesticidi.
V. Danel, P. Barriot. Les intoxications aigues. Arnette
M. Bozza Marrubini, R. Ghezzi Laurenzi, P. Uccelli. Intossicazioni acute.OEMF, 2a edizione 1987
P. Viccellio. Handbook of medical toxicology. Little, Brown and Company
JE. Davies, A. Barquet, VH. Freed, R.
Haque, C. Morgade, RE Sonneborn, C.Vaclavek. Human pesticide poisoning
by a fat-soluble organophosphate insecticide. Arch Environ Health
1975 ; 30 :608-613
______________________________________________________
4 MANUALI DI ANESTESIA:Riduzione e fissazione interna di fratture prossimali
______________________________________________________
Questa rubrica, curata dal dott. Lelio Guglielmo, presenta i protocolli anestesiologici adottati ,nelle varie specialità chirurgiche , dal Servizio di Anestesia e Rianimazione dell' Ospedale Buccheri La Ferla. Questi manuali che sono il frutto di studi e dell'esperienza di oltre 15 anni di attività anestesiologica non pretendono ovviamente di avere un carattere "universale" . E' evidente altresì che l'applicazione delle procedure descritte va valutata criticamente in relazione al proprio ambiente di lavoro. La parte riguardante le considerazioni chirurgiche è stata realizzata in collaborazione con i chirurghi delle varie specialità, operanti nel nostro ospedale.
Qualsiasi commento o critica è
bene accetta e può essere inviata a leliobuc@mbox.vol.it.
oppure alla redazione LANZA@mbox.unipa.it
RIDUZIONE E FISSAZIONE INTERNA DI FRATTURE PROSSIMALI DEL FEMORE |
Considerazioni chirurgiche
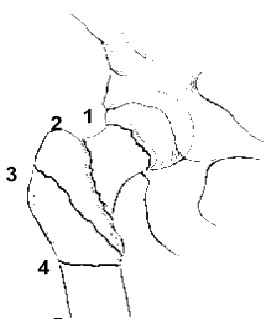 | Le fratture prossimali del femore si verificano generalmente nei pazienti molto anziani, per cedimento di un collo femorale osteoporotico, e nei pazienti giovani, per cause traumatiche. Si distinguono fratture intracapsulari (f.i.1-2) fratture extracapsulari (f.e.3-4). Nel caso di f.i. senza spostamento dei due frammenti si utilizzano dei sistemi placca-viti ; se è presente uno spostamento si posiziona una endoprotesi (cementata se pz. >di 75 a.) o una artroprotesi totale in presenza di una degenerazione artrosica del cotile. Nel caso di f.e. si utilizzano: una placca con vite nel caso di fratture stabili (corticale mediale non fratturata) in pz. < di 75 a. ; un chiodo CEB nel caso di fratture non stabili in pazienti >di 70a; un chiodo IMHS nelle fratture instabili più complesse. |
SOMMARIO DELLE PROCEDURE
F. intracapsulari F.intracapsulari F.extracapsulari
non scomposte scomposte
Posizione supina lat. supina
Incisione laterale coscia <-----
<-------
Strumenti viti endo/artroprotesi chiodi IHMS
CEB-vite placca
Consid.speciali lettino operatorio nessune lettino operatorio
da trazione ed RX da trazione ed RX
Antibiotici Ceftriaxone 2gr. <------
<--------
T.chirurgico 30-90min <------- <------------
Perdite ematiche <200ml 250-500ml
250-500ml
Post-operatorio reparto
Mortalità 10% (++anziani) <------ <---------
(nei success.30 gg.)
Morbidità Disritmie:50%
Infarto :10-20%
Infez.urinaria:50%
Tromboembol.:10%
Infezione ferita:1-5%
Pain score 5-6 7 8
CARATTERISTICHE DELLA POPOLAZIONE DEI
PAZIENTI
Età: >60a.:occasionalmente 16-35a.
Maschi/Femmine: 1/4.5
Eziologia: Incidenti e cadute
Fratture patologiche
Fratture multiple
Fratture da stress
Condizioni Numerose patologie mediche associate
associate Demenza senile
Considerazioni anestesiologiche
PREOPERATORIO
Questo tipo di chirurgia riguarda in
genere paziento molto anziani che soffrono di patologie che possono
influire sull' outcome chirurgico. Occorre quindi porre molto
attenzione alla condizioni mediche di base. Il trauma della frattura
e le conseguenze ad esso legate (disidratazione, allettamento,
denutrizione, etc.) rendono il paziente più esposto a rischi.
Sebbene le fratture di femore siano considerate delle urgenze
numerosi dati della letteratura suggeriscono di ottimizzare
lo stato medico del paziente prima della chirurgia. Un'appropriata
valutazione del paziente include una revisione degli apparati
del paziente e una indagine sulle cause della frattura: TIA? Sincope?
Aritmia?, Ictus? o semplicemente una caduta accidentale?.
App.Respiratorio: L'immobilizzazione del paziente può determinare un'affezione bronchiale o polmonare. Nell'anamnesi possono essere presente una storia di bronchite cronica, asma ed altre affezioni respiratorie croniche. Livelli basali di PO2< a 70mmHg in aria sono consueti in questi pazienti e spesso è il risultato di microembolie di grasso e della deposizione intravascolare di piastrine e fibrina.
App.Cardiovascolare: Occorre eseguire con cura l'esame obbiettivo per individuare segni patologici e ricercare eventuali antecedenti cardiologici. Verrà richiesta la consulenza cardiologica e l'esame ecocardiografico nei casi più a rischio (infarto recente, malattia ischemica, insuffi.cardiaca, valvulopatie etc.). Secondo studi recenti, cinque sono i fattori preoperatori predittivi di ischemia miocardica postoperatoria: ipertrofia ventricolare sn, ipertensione, diabete, insufficienza coronarica, e l'uso di digossina. Il rischio ischemico aumenta con il numero di fattori presenti (dal 22% senza fattori presenti al 77%con quattro fattori predittivi presenti). Frequentemente si riscontra una storia di ipertensione e/o di diabete.
App.neurologico:
Valgono le stesse considerazioni già fatte nei pazienti
operati per protesi d'anca e cioè l'alta percentuale di
pazienti affetti da un qualche grado di alterazione mentale o
da M.di Parkinson. Questi ultimi sono più a rischio di
sviluppare una insufficienza respiratoria postoperatoria a causa
di anormalità della funzione e della coordinazione dei
muscoli respiratori.
INTRAOPERATORIO
Premedicazione: standard
Dobutamina : secondo protocollo
Anestesia : AS (Marcaina iperbarica 1% 0.8-1.2 ml ± 0.3 adrenalina). Iniettare
prima dello spostamento in decubito lat. 2-3 ml di Diprivan (paz.
molto sofferenti!!)
Posizionamento: supino su lettino speciale da fratture (arto in trazione)
Monitoraggio : ECG,SaO2, tcPO2-PCO2 , Pa generalmente incruenta
Sedazione : infusione Diprivan 7-15ml/hr
Complicanze
: embolia adiposa
POSTOPERATORIO
Complicanze : Ipossiemia
Ossigeno-terapia : Somministrare 1-2 l. di O2 per sondino nasale x 24-48 ore
Analgesia postop.:
Diclofenac 75mg.x2 oppure Meperidina 25-50mg. IM x2
-----------------------------------------------------------------------------------------
Informazioni sulla rivista
EDUCATIONAL SYNOPSES IN ANESTHESIOLOGY
and
CRITICAL CARE MEDICINE-Italia-
Educational Synopses in Anesthesia and Critical Care Medicine-Italia costituisce la parte Italiana della versione Americana, pubblicata su Internet da Keith J Ruskin, Professore di Anestesia alla Università di Yale. I lavori saranno accettati sia in lingua Italiana che Inglese. In quelli di lingua Italiana un corposo riassunto in Inglese verrà preparato dalla redazione,qualora l'autore non fosse in grado di fornirlo.A cura della redazione sarà inoltre la traduzione in Italiano dei manoscritti inviati in lingua Inglese.La rivista sarà inviata gratuitamente a tutti quelli che ne faranno richiesta
inviando il seguente messaggio "Desidero ricevere ESIA versione italiana" indirizzato a LANZA@MBOX.UNIPA.IT
La rivista pubblica rewiews e lavori originali compiuti nei campi dell'anestesia e della medicina critica. I lavori originali riguardano ricerche cliniche, di laboratorio e la presentazione di casi clinici. Le reviews includono argomenti per l' Educazione Medica Continua (EMC), articoli di revisione generale o riguardanti le attrezzature tecniche. ESIA pubblica le lettere all'Editore contenenti commenti su articoli precedentemente publicati ed anche brevi comunicazioni.La guida per gli autori può essere consultata collegandosi al sito ANESTIT all'indirizzo:
http://mbox.unipa.it/~lanza
utilizzando la sezione riservata ad ESIA-Italia
Oppure può essere richiesta inviando un messaggio a
lanza@mbox.unipa.it
EDUCATIONAL SYNOPSES IN ANESTHESIOLOGY
and
CRITICAL CARE MEDICINE Sezione Italiana
E' anche ottenibile attraverso World-Wide Web WWW: L' URL per questo numero di ESIA è:
http://mbox.unipa.it/~lanza/esiait/esit9611.txt
Il nome della rivista è
esitaamm, dove aa è l'anno ed mm il mese
(per esempio questo numero è esit9611.txt)
LA REDAZIONE DI ESIA ITALIA
DIRETTORE
Vincenzo LANZA
Primario del Servizio d'Anestesia e Rianimazione Ospedale Buccheri La Ferla Fatebenefratelli
Palermo LANZA@MBOX.UNIPA.IT
Terapia Intensiva
Antonio Braschi
Primario del Servizio d'Anestesia e Rianimazione 1
Policlinico S. Matteo - IRCCS Pavia
Anestesia Cadiovascolare
Riccardo Campodonico
Responsabile dell'Unità di Terapia Intensiva Cardiochirurgica
Azienda Ospedaliera di Parma ricrob@mbox.vol.it
Anestesia e malattie epatiche
Andrea De Gasperi
Gruppo trapianti epatici / CCM
Ospedale Niguarda - Milano
Medicina critica e dell'emergenza
Antonio Gullo
Professore di Terapia Intensiva
Direttore del Dipartimento di Anestesia e Terapia Intensiva-Università di Trieste
Anestesia ed informatica
Vincenzo Lanza
Primario del Servizio d'Anestesia e Rianimazione Ospedale Buccheri La Ferla Fatebenefratelli
Palermo
Tosssicologia
Carlo Locatelli
Direttore del Centro di Informazione Tossicologica Centro antiveleni di Pavia
Fondazione Scientifica
"Salvatore Maugeri Clinica del Lavoro e della Riabilitazione"
Pavia
Terapia Antalgica e Cure Palliative
Sebastiano Mercadante
Aiuto del Servizio d'Anestesia e Rianimazione
Ospedale Buccheri La Ferla Fatebenefratelli
Palermo